研究对糖尿病的病因有了新的认识
根据宾夕法尼亚州立大学的一组研究人员提出的一项新假设,新生儿胰岛素依赖的永久性糖尿病的原因可能是在出生前发育的关键时期缺乏胰内质网激酶(PERK)。
在这种最严重的糖尿病类型中,患者无法正常调节葡萄糖,因为他们的胰腺中产生胰岛素的β细胞很少,而剩余的细胞不能产生足够的胰岛素。研究人员通过培育缺乏perk的特殊小鼠,证明缺乏这种酶会阻碍β细胞的增殖,阻碍β细胞的正常功能,也会阻止β细胞聚集成胰岛。
“胎儿发育过程中所发生的事情决定了人们要么能够维持正常的血糖水平,要么患上糖尿病,”团队负责人、生物系教授道格拉斯·卡文纳说。研究结果将发表在该杂志上细胞代谢2006年12月6日
该团队由研究生张伟、李玉林、饭田kaori、博士后冯daorong和研究助理教授Barbara McGrath组成,他们利用了实验室早期的发现,即缺乏PERK的小鼠与人类沃特-瑞森综合征(WRS)患者有许多相似之处,在WRS中,糖尿病伴有骨骼和生长异常。这项研究为研究永久性新生儿糖尿病的原因提供了一个实验模型,比细胞培养研究更具启发性。
“能够在特定器官或组织中培养出缺乏perk的特殊小鼠品系对我们的研究至关重要,”Cavener说。“这些小鼠使我们能够准确地发现PERK是如何参与胰腺中分泌胰岛素的β细胞的发育和生长的。以这种方式利用遗传学,让生物体告诉你什么对正常功能重要。”
正常情况下,胰腺的β细胞对血液中高水平的葡萄糖做出反应,在内质网中产生胰岛素的前体——胰岛素原。在这个和其他细胞器中,胰岛素原被组装并修饰成胰岛素。然后,激素从细胞中输出,刺激其他组织吸收葡萄糖并产生能量。
缺乏perk的小鼠与正常小鼠有显著差异。在出生时,缺乏perk的小鼠只有正常小鼠β细胞质量的一半左右。在出生后的最初几周,与正常小鼠相比,缺乏perk的小鼠的β细胞越来越少,剩余的细胞在产生胰岛素方面不能正常运作。出生三周后,缺乏perk的小鼠完全患有糖尿病,β细胞质量只有正常小鼠的十分之一。
到目前为止,关于缺乏PERK的小鼠和人类糖尿病原因的主要假设是由纽约大学医学中心的希瑟·哈丁和大卫·罗恩在2001年提出的。他们认为,内质网中过多的胰岛素原会引发应激反应,导致许多β细胞死亡。在缺乏perk的小鼠中,β细胞的缺乏被认为是由这些细胞的高死亡率引起的。
Cavener团队收集的数据对这一假设提出了质疑。首先,他们发现缺乏PERK的小鼠产生新β细胞的速度比正常小鼠低得多。缺陷小鼠的β细胞质量在生命的最初几周内只增加了一倍,而正常小鼠的β细胞质量增加了20倍。其次,宾夕法尼亚州立大学的研究小组发现,缺乏perk的小鼠的β细胞死亡率与正常小鼠没有显著差异。最后,研究小组没有在他们的perk缺陷小鼠的β细胞中检测到内质网应激的分子标记。
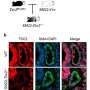
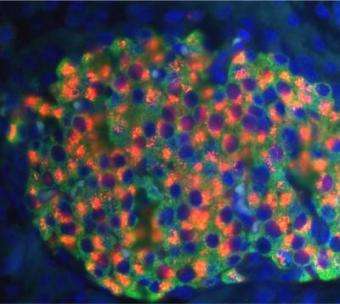
宾夕法尼亚州立大学研究小组的另一种假设是,PERK缺陷既阻碍了出生后β细胞的增殖,也阻碍了这些细胞分化成功能完整的单元。他们发现,在缺乏perk的小鼠中,30%到40%的β细胞在生理上是不寻常的。最明显的异常是胰岛素原存在于内质网,而不是在细胞核内或周围。显然,胰岛素原照常产生,但正常的修饰过程被阻断,使大量的胰岛素原被困在扩大和膨胀的细胞器内。
另一个重要的发现是,这些小鼠的β细胞没有在胰腺内发育成有组织的簇或胰岛。正常情况下,GLUT2蛋白在胰岛之间通过质膜运输葡萄糖,触发β细胞分泌胰岛素。但是如果没有胰岛结构,β细胞之间的交流就会中断,细胞就不能通过分泌胰岛素来对葡萄糖做出反应。因此,缺乏perk既阻碍了葡萄糖水平的细胞间信号传递,也大大降低了细胞水平的胰岛素产生。
宾夕法尼亚州立大学的研究小组对PERK作用的理解是通过额外的实验来提高的,以确定在开发过程中需要PERK的时间。Cavener的研究小组发现,如果胰腺的β细胞想要在动物的余生中正常调节葡萄糖,那么PERK必须在胎儿出生后13.5天到出生后4天之间的关键时期表达。PERK可能在感知胎儿环境和调节β细胞的发育中发挥重要作用。
“胎儿的遗传程序和子宫内环境共同作用,建立了在出生后调节葡萄糖的装置,”Cavener解释道。
来源:宾夕法尼亚州立大学