意想不到的蛋白质相互作用表明新的ALS药物目标
发现了一个意想不到的蛋白质相互作用导致了爱荷华大学的科学家和同事确定药物,减缓了肌萎缩性脊髓侧索硬化症(ALS)的发展在小鼠和几乎翻倍的动物的寿命。1月24日在线发表的研究临床研究杂志。
UI发现可能导致治疗某些形式的肌萎缩性侧索硬化症,和研究还揭示了一个生物机制,可能代表一种新药目标ALS和其他神经系统疾病。
肌萎缩性侧索硬化症,也被称为卢伽雷氏症,是一种致命的进行性神经退行性疾病,影响大脑和脊髓的运动神经细胞。运动神经元的变性损害肌肉控制和运动,最终导致瘫痪和死亡。“零星”肌萎缩性侧索硬化症,这可以影响任何人,是最常见的疾病占90 - 95%的情况下在美国。大约5 ALS继承案件的10%。
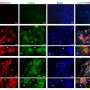
在研究细胞信号传导的基本生物学,科学家们由约翰·恩格尔哈特博士,教授、解剖学和细胞生物学在UI中罗伊·j .和露西尔·a·卡佛医学院,意想不到的发现,超氧化物dismutase-1 (SOD1),一种蛋白质,这种蛋白质在遗传变异形式的肌萎缩性侧索硬化症,与Rac1相互作用,蛋白质调节生产活性氧(ROS)的Nox2蛋白质复杂。
ROS是短暂的,高活性分子,对正常的细胞功能包括信号至关重要。然而,过量的活性氧会导致有害的氧化应激,和异常的活性氧产量与ALS和其他神经退行性疾病的一个原因。
意想不到的一种蛋白质,这种蛋白质之间的相互作用是细胞突变在家族性肌萎缩性侧索硬化症和机械产生活性氧,与ALS进展,促使科学家们进一步调查。
最近,他们发现删除Nox2蛋白质几乎翻老鼠的寿命与ALS的遗传形式,加强认为Nox2-generated ROS在ALS进展中发挥作用。在他们的最新研究中,研究人员表明,药物名为apocynin块Nox2,同样缓慢发展和增加ALS-affected老鼠的寿命。
虽然apocynin结果相当戏剧性的老鼠,和药物似乎没有有毒的动物,恩格尔哈特警告说,严格的安全性和有效性测试需要在临床前和临床试验来确定药物在人类也可能是有用的。
“我们非常兴奋帮助将这些发现对临床试验,”保尔森补充说,医学博士博士,神经学家和研究报告的作者。“是一个伟大的需要有效的治疗方法在这种毁灭性的,致命的障碍。”
然而,恩格尔哈特和保尔森,他是一个UI神经学教授在研究过程中,现在是一个密歇根大学的神经学教授警告说,目前还不清楚如果ALS的药物将有助于形式不是SOD1突变造成的;ALS的所谓的“零星的形式”。这个问题不能通过实验解决,因为没有为零星的形式肌萎缩性侧索硬化症小鼠模型。
尽管这款鼠标的潜在临床意义研究,恩格尔哈特同样兴奋底层发现促使团队测试Nox2抑制剂ALS-affected老鼠。
“发现的基本机械SOD1与Rac1相互作用可能是我职业生涯中最重要的发现,它本质上是偶然,”恩格尔哈特说,他也是分子医学的罗伊·j·卡佛的椅子。“这是令人兴奋的不仅从ALS的角度来看,也因为对理解的影响基本细胞生物学。Rac1有牵连在许多细胞过程包括细胞迁移、增殖和分化,炎性疾病过程的一个重要组成部分。”
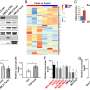
通过一系列的实验细胞和小鼠,研究人员探索SOD1和Rac1之间的交互。
“当SOD1结合Rac1, Nox2蛋白质产生活性氧,”恩格尔哈特解释道。“然而,只要有过多的活性氧(过氧化氢),SOD1分离从Rac1 Nox2复杂停止产生活性氧。从本质上讲,SOD-1就像一个恒温器,感官ROS和告诉Nox2复杂何时停止产生活性氧。
“相比之下,SOD1突变版本,导致肌萎缩性侧索硬化症,ROS并不敏感,不脱离Rac1。与温控器坏了,变异SOD-1使ROS-producing炉燃烧的细胞,”恩格尔哈特说。
结果表明之间的不正常交互SOD1基因突变和Rac1负责,至少在某种程度上,生产过剩的活性氧在家族性肌萎缩性侧索硬化症和受伤的原因。
虽然在ALS神经细胞死亡的确切机制还不清楚,同时氧化应激(过量的活性氧所致),严重炎症,这是由于ROS信号,似乎发挥了作用。氧化应激和炎症也涉及其他神经退行性疾病。
“Redox-activated通路,特别是这些通路的失调,可能是许多类型的神经退行性疾病的一个组成部分,”恩格尔哈特说。“我们发现Rac1-SOD1交互可能会发现其他神经退行性疾病的新药物靶点redox-stress组件”。
来源:爱荷华大学