长期升高的血糖水平会使“禁食开关”失效
由于暴饮暴食和肥胖导致的胰岛素分泌不断增加,会慢慢减弱身体对胰岛素的反应。结果,血糖水平开始上升,为糖尿病相关并发症,如失明、中风和肾功能衰竭创造了条件。更糟糕的是,长期升高的血糖浓度会加剧胰岛素抵抗。
索尔克生物研究所(Salk Institute for Biological Studies)的研究人员发现,当失控的血糖水平使分子开关失效时,恶性循环就开始了。这种分子开关通常会在胰岛素水平上升时关闭肝脏中生成糖分的功能。
他们的研究结果发表在3月7日的《科学这表明,适当的抑制酶途径阻断“糖断”开关可能有助于降低糖尿病患者的血糖水平和减少与该疾病相关的长期并发症。
“当面对慢性肥胖和缺乏运动时,胰腺中的胰岛细胞只能在一定时间内通过增加胰岛素分泌来补偿,”克莱顿基金会肽生物学实验室的教授Marc Montminy博士说,他领导了这项研究。“结果,葡萄糖水平开始上升,引发一系列问题。”
就像可使用汽油或乙醇的弹性燃料汽车一样,人体也可以在不同类型的燃料之间切换:在白天,人体主要燃烧葡萄糖,而在夜间或长时间禁食时,人体主要燃烧脂肪。但是无论是弹性燃料发动机还是人类大脑都不能只依靠乙醇或脂肪运转——需要加入少量的汽油或葡萄糖才能使两者保持运转。
三年前,蒙米尼发现了一种名为CRTC2(以前称为TORC2)的“禁食开关”,当夜间血糖水平较低时,它会启动肝脏中的葡萄糖生成。在餐后,胰岛素通常会关闭CRTC2,以确保血糖水平不会太高。
然而,在许多II型糖尿病患者中,CRTC2对升高的胰岛素水平不再有反应,结果肝脏就像一个加班加点的糖工厂,一整天都在大量生产葡萄糖,即使血糖水平很高。索尔克的研究人员对导致通常严格控制的反馈回路崩溃的分子机制很感兴趣。
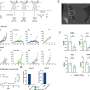
CRTC2一启动,荧光素酶基因就会使小鼠的肝脏发亮,这是萤火虫发光的原因。该研究的博士后兼第一作者Renaud Dentin博士带领着他们开始探索氨基生物合成途径。该通路的激活促进了糖分子向蛋白质的添加,这一过程也被称为o -糖基化。“众所周知,循环葡萄糖浓度的增加会激活己糖胺的生物合成途径,”牙登说。“但我们不知道由此产生的o糖基化会将CRTC2锁定在‘开’的位置。”
通常情况下,餐后胰岛素水平的上升会激活一种叫做SIK2的肝酶。这种酶在化学上用一个磷酸基标记CRTC2,将蛋白质隔离在细胞核外。CRTC2无法接触到参与糖异生的基因,无法启动这些基因,肝脏中的葡萄糖生产就停止了。
然而,在葡萄糖水平过高的情况下,通过添加糖分子,己糖胺生物合成途径被激活,并阻断CRTC2上关键的磷酸化位点。CRTC2不再因胰岛素水平上升而磷酸化,现在可以自由地滑入细胞核,保持糖异生过程的进行。
研究人员推断,关闭o -糖基化途径就能控制人体自身的葡萄糖生产。正如预测的那样,当Dentin和他的同事降低胰岛素抵抗型糖尿病小鼠和高脂肪饮食的小鼠的肝脏中己糖胺生物合成途径的活性时,葡萄糖耐量和胰岛素敏感性显著提高,这两种小鼠都患有高血糖。
“我真正想做的是使用发光的老鼠来筛选减少糖异生的药物,”蒙特米尼说。“想象一下,由于CRTC2一直处于激活状态,高血糖小鼠的肝脏会变亮。当你喂它们一种抑制o糖基化的药物时,光线变暗,你就知道这种化合物对活的动物有效,你就知道它是如何工作的。”
资料来源:索尔克研究所