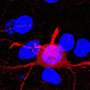
DNA-MVA HIV候选疫苗的人体临床试验开始
一项名为RV262的第一阶段研究最近开始评估一种DNA启动物/MVA载体增强疫苗组合方案,该方案被开发用于预防在北美、欧洲、非洲和南美流行的不同亚型HIV-1。
美国国立卫生研究院(NIH)下属的国家过敏和传染病研究所(NIAID)赞助了这项研究,该研究将招募92名参与者,旨在评估安全性和免疫反应。这项研究由美国军方艾滋病毒研究项目(MHRP)通过其在美国、东非和泰国的临床研究网络进行。
这项临床试验旨在测试一种独特的prime-boost预防性HIV疫苗接种策略目标是全球覆盖。启动剂是一种质粒DNA疫苗PENNVAX™-G,增强剂是一种病毒载体疫苗,改良的安卡拉-清迈双重组痘苗(MVA-CMDR)。这些疫苗的设计目的是为HIV-1亚型a、B、C、D和E提供不同的抗原混合物。
单独来看,基于dna和基于mva的策略在临床前和临床试验中已被证明是安全的和免疫原性的。研究人员希望他们可以通过使用这种启动-增强策略来增强免疫反应。本研究的另一个显著特征是在启动(A,B,C,D)和增强(A/E)期间使用了不同的HIV抗原,这是作为一种手段来增加研究的广度免疫反应.
“我们假设,这种具有亚型不匹配插入物的疫苗方案将促进亚显性表位的出现,并增加免疫反应的总体广度,”MHRP疫苗研发部门负责人、该研究的议定书主席Mary Marovich博士指出。
该DNA疫苗由宾夕法尼亚大学David B. Weiner教授的实验室设计,并获得Inovio制药公司的许可,用于进一步的临床产品开发。增强疫苗组成部分以改良安卡拉牛痘(MVA)为基础,是一种改良的天花疫苗,已在全球安全有效地用于根除该疾病。MHRP和NIAID的研究人员开发了MVA疫苗。
从历史上看,DNA疫苗的效力一直受到限制,因为无法将足够的DNA传递到细胞中,细胞表达由DNA编码的抗原。为了解决这个问题,研究人员还将测试DNA启动物的两种肌内传递方法(PENNVAX™-G),以比较它们对免疫反应的影响。本研究将测试的两个设备是Biojector®2000和CELLECTRA®EP(电穿孔)设备。
Biojector是一种无针注射系统,已获得FDA的疫苗和其他注射药物的许可。CELLECTRA EP系统是一种肌内电穿孔设备,目前正在进行评估临床试验作为一种替代的疫苗输送系统,以增加比标准针和注射器注射引起的免疫反应。电穿孔技术是将可控的毫秒电脉冲应用于细胞,以增强细胞对疫苗的吸收。
“我们对这项重要的临床试验的启动感到非常兴奋,该试验探索了新药的作用艾滋病毒疫苗方法建立在RV144泰国主要增强试验的成功基础上,”MHRP主任和沃尔特里德陆军研究所(WRAIR)逆转录病毒学部门的COL Nelson Michael说。“电穿孔作为一种启动DNA疫苗的递送方法的作用将是评估初始I期安全性和免疫原性试验的一个特别关键的因素。”
一旦疫苗在美国12名未感染艾滋病毒的参与者中,该组合已被评估为安全且可接受,该研究将在四个MHRP站点开始:肯尼亚克里乔;坎帕拉,乌干达;Mbeya、坦桑尼亚;泰国曼谷。每个站点将招募20名健康、未感染艾滋病毒的参与者,共计80名国际参与者。
该临床试验是由Bioject医疗技术公司、Inovio制药公司、亨利·m·杰克逊军事医学发展基金会、NIAID和美国陆军/MHRP合作进行的。