干细胞模型继承了ALS的原因提供了线索
一个国际科学家小组在加利福尼亚大学的研究人员的领导下,圣地亚哥医学院使用诱导多能干细胞(万能)来自患者肌萎缩性脊髓侧索硬化症(ALS)首次揭示如何减少水平的一个特定的蛋白质可能发挥核心作用导致至少一个继承形式的疾病。
这项工作发表在2011年6月在线出版的杂志人类分子遗传学可以帮助科学家克服的主要障碍的研究和治疗肌萎缩性侧索硬化症,一种无法治愈的神经肌肉疾病也被称为卢伽雷氏症。ALS是普遍致命的,55年的发病的年龄中位数和症状出现后两到五年的生存。过去的研究工作一直受阻于困难翻译成功的药物测试ALS对人类的动物模型。
“ALS迫切需要人类模型可以转化为在人类临床试验来验证的治疗目标遗传背景Alysson r . Muotri说:“博士,加州大学圣地亚哥分校助理教授儿科部门和细胞和分子医学,和该研究的资深作者之一。bob电竞“啮齿动物在过去已经使用,仍有至关重要的影响在揭幕ALS的复杂性,但绝大多数已经证明疗效的药物在动物模型中没有相同的临床前和临床人体试验。”
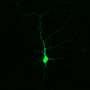
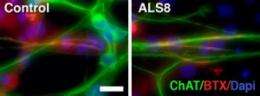
在新的工作中,Muotri和他的同事则来自于皮肤细胞一种家族的ALS患者的称为ALS8创建运动神经元提供一种新型疾病的体外模型。万能ALS患者之前已经被描述,但发现细胞和分子表型已经证明是一个持续的挑战。家庭形式的ALS的使用提供了一个优势因为变异的基因可以被跟踪在运动神经元分化。
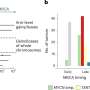
“我们不知道是什么原因导致大多数情况下的肌萎缩性侧索硬化症,但对大约10%的ALS患者来说,这种疾病是遗传基因突变的结果,“Muotri说。“这些家族形式之一是ALS8 VAPB基因的突变的结果。使用万能几个病人来自两个独立的家庭,我们发现VAPB蛋白质水平降低ALS8-derived运动神经元相似的细胞相比,非承运人的兄弟姐妹ALS8病人。”
Muotri表示,该发现表明VAPB蛋白质水平降低可能是一个关键的发展ALS8或者其他形式的疾病,包括零星或非遗传性肌萎缩性侧索硬化症,VAPB减少蛋白质含量也被记录。
“VAPB蛋白是参与许多细胞过程,所以看起来有可能导致其他形式的ALS的发病机理,“Muotri说。“我们还不知道VAPB参与的损失导致家族性或零星的肌萎缩性侧索硬化症,但新的研究这种疾病在人类细胞的能力提供了一个前所未有的机会来回答这个问题,开发新的早期诊断工具和确定新的目标为未来的药物和疗法。”