2011年10月27日报告
神经免疫学家发现肠道细菌与多发性硬化症有关
(bob游戏医学快报)——马克斯普朗克神经生物学研究所的研究人员发现,小鼠的共生肠道菌群是导致多发性硬化症(MS)的免疫触发过程的重要组成部分。他们的论文发表在自然,由Gurumoorthy Krishnamoorthy和Hartmut Wekerle领导的团队写道,导致疾病的微生物环境因素在没有常见肠道细菌的情况下无法发挥作用,因此他们发现这些细菌是导致广谱神经系统疾病(MS)的一系列事件中的必要环节。
当覆盖在大脑轴突和脊髓上的髓鞘由于免疫系统的攻击而开始恶化时,人们就会患上多发性硬化症。这导致神经细胞之间无法交流,使受影响的人出现一系列个性化的症状,从麻木、刺痛和肌肉损失到听力、视力和吞咽问题。虽然启动这一过程的特定环境微生物因素仍然未知,但德国团队的这项新研究表明,如果没有肠道中至少一些细菌的帮助,这一过程无法继续。
研究人员发现了肠道细菌的联系,他们让经过基因工程改造的出现类似多发性硬化症症状的测试小鼠服用一定剂量的抗生素,以杀死它们所有的细菌肠道细菌.结果,他们发现小鼠的免疫系统不再攻击髓鞘,因此它们从未患多发性硬化症。然而,当随后引入肠道细菌时,80%的小鼠出现了症状。
尽管有了这一新的线索,科学家们仍然对是什么样的遗传倾向导致了这一问题感到困惑免疫系统一些人对某些未知的微生物因素做出反应,这似乎会导致兴奋的T细胞在淋巴结中盘旋,与B细胞汇合,然后一起前往大脑和脊髓,开始攻击它们发现的神经上的髓鞘涂层。
该研究项目的下一步将是一个淘汰过程,试图找出哪些肠道细菌对这一系列事件的进行是必要的。
摘要
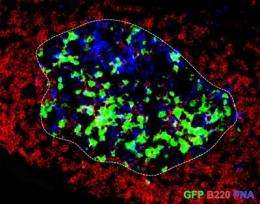
活动性多发性硬化症病变显示炎症变化,提示自身反应性T和B淋巴细胞对脑白质的联合攻击。这些致病性免疫细胞来源于正常的、无害的健康免疫库组成部分的祖细胞,但在病理激活时成为自侵略性的。触发这种自身免疫转换的刺激通常归因于环境因素,特别是微生物感染。然而,使用自发发展的实验性自身免疫性脑脊髓炎的复发缓解小鼠模型,我们在这里表明,共生肠道菌群(在缺乏致病因子的情况下)在触发免疫过程中是必不可少的,导致髓磷脂特异性CD4+ T细胞驱动的复发缓解自身免疫性疾病。我们进一步表明,从内源性免疫库中招募和激活产生自身抗体的B细胞取决于目标自身抗原、髓鞘少突胶质细胞糖蛋白(MOG)和共生菌群的可用性。我们的观察确定了一系列触发器官特异性自身免疫性疾病的事件,这些过程可能提供新的治疗靶点。
©2011 PhysOrg.com