系统生物学方法揭示,肥胖人群的肠道微生物网络与正常情况不同
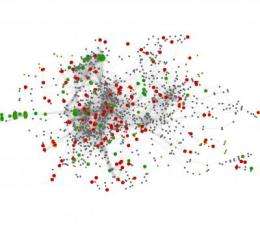
研究人员首次将居住在人体肠道中的大量微生物作为一个复杂的综合生物系统进行分析,而不是一组独立的物种。他们的方法揭示了与超重相对应的模式。
收集微生物的内部人类肠道是一个基因相互作用和能量利用的繁忙网络。通过建立这些模型微生物群落在美国,科学家们发现了肥胖者和瘦人之间的新区别。
他们能够检测到明显超重的人和体重超标的人的肠道菌群从正常的“瘦”状态发生的组织变化炎症性肠病.研究结果发表在美国国家科学院院刊.
该论文的资深作者,华盛顿大学基因组科学助理教授Elhanan Borenstein说:“我们的研究引入了一个新颖的框架,适用于系统生物学并在硅(计算机)建模研究人体微生物组-复杂的集合微生物作为一个单一的内聚系统,它们遍布人体。”
沙伦·格林布卢姆来自华盛顿大学基因组科学和哈佛大学FAS系统生物学中心的Peter J. Turnbaugh都是该研究小组的成员。Borenstein还在华盛顿大学计算机科学与工程系担任兼职,并且是圣达菲研究所的外部教授。
该团队的方法是将人类微生物组视为一个有凝聚力的“超级有机体”,其中来自多个微生物物种的基因协同作用,就好像它们是单个有机体的一部分一样。
博伦斯坦说,全球范围内的研究都强调了微生物群是如何影响人类健康的。微生物组对人体发育、免疫和营养至关重要。
人体内有超过100万亿个微生物。这些微生物生活在人体解剖结构上和内部的各种栖息地;肠道是所有细菌中密度最大的,含有数百种细菌。它们的集体基因集是巨大的:比人类基因集大150倍。
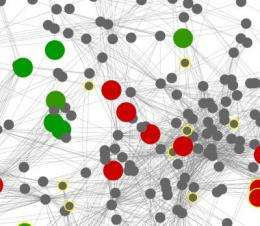
肠道微生物组通过制造维生素和蛋白质的组成部分,从食物中提取能量,并赋予抗病性来帮助我们维持生命。以前对肠道微生物组的研究,包括将供体微生物组转移到受体,表明对肠道微生物组的操纵肠道菌群可能有临床应用价值。
该论文的第一作者格林布卢姆说:“描述肠道微生物群及其与人类宿主的相互作用,有可能深入了解正常的人类生理和疾病状态。”
绘制人类微生物组图谱的研究人员正在发现以前未知的物种和基因。遗传学研究确定了人类微生物组中不同物种的相对丰度,并将不同物种的组合与某些人类条件联系起来。研究人员已经观察到,肥胖者和瘦子的肠道微生物群存在差异。
根据Borenstein的说法,初步的发现仍然缺失的是一个全面的、系统级的理解,即微生物组基因组成的这些变化如何影响其组织,从而影响其代谢潜力(能量的产生、使用和储存)及其对人类宿主的影响。
Borenstein的团队从之前的两项研究中获得了数据集,这些研究描述了瘦子和肥胖者以及炎症性肠病患者肠道微生物群中的一组基因。
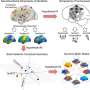
该团队使用先进的计算技术重建了这些微生物群落的模型以及各种基因之间的相互作用。该小组还估计了与不同宿主状态相关的酶的丰度变化:消瘦、肥胖或受炎症性肠病影响。
他们的模型反映了酶之间的代谢相互依赖性,而不是它们在肠道中的物理位置。某些相互作用对微生物群落的新陈代谢至关重要。然而,那些代表肥胖或消瘦的酶大多远离核心网络及其关键代谢功能。这些酶在模型网络的外围起作用。研究人员推测,这些外周酶可能代表了代谢的第一步,依赖于非微生物组制造的物质或释放非微生物组使用的产物的终点。
Borenstein解释说,这种酶很可能直接使用或产生具有肠道环境特征的物质,并在微生物和人体代谢之间形成界面。
Borenstein说:“我们的研究结果表明,与肥胖和炎症性肠病相关的酶水平变化与微生物组与人类肠道环境相互作用的变化有关,而不是微生物组核心代谢过程的变化。”
他说,其他研究结果表明,肥胖微生物群具有利用多种能量来源的潜在能力,这可能是它们从饮食中提取能量的能力增强的原因。这种系统方法也为肥胖和炎症性肠病提供了可能的生物标志物。这些标记可以指示疾病的共同潜在诱因或疾病的反应肠道微生物对疾病的影响。
肥胖和精益微生物群网络模型之间的比较还表明,肥胖微生物群与一种称为“模块化”的拓扑特征的较低水平有关。肥胖微生物群落的模块化程度降低,类似于居住在更稳定环境中的单一物种。
虽然从这项研究中得出的关联可能并不清楚地暗示了肥胖和炎症性肠病等复杂和尚不清楚的疾病的特定机制,但Borenstein指出,它们证明了使用系统生物学方法来研究人类微生物群及其对人类健康的贡献的前景。