团队使用反义技术,利用基因剪接机制来杀死癌细胞
癌细胞快速增长。这是一个重要的特征是什么让他们癌细胞。他们通过细胞循环检查点和坠毁不断生长和分裂,远远超过我们的正常细胞。为此他们需要加快新陈代谢。
3 Adrian报告教授和他的团队已经找到了一种方法针对癌症细胞代谢过程在这个过程中,特别是杀死癌症细胞。
近90年前,德国化学家诺贝尔奖得主奥托·沃伯格提出,癌症的主要原因是改变细胞代谢——即。,在细胞的能源生产和消费。特别是肿瘤细胞有一个顽固的倾向避免使用葡萄糖作为产生能源。这是被称为Warburg效应。
而代谢变化转换的一个重要特性正常细胞癌症细胞他们现在并不认为是癌症的主要原因。尽管如此,代谢变化仍是一个有吸引力的目标癌症治疗报告和同事在今天在线发表的一篇论文开放的生物学英国皇家学会的开放获取期刊。
一个区别在癌症和正常细胞代谢是癌症的开关的生产不同的版本,或同种型,产生的蛋白质丙酮酸激酶- m (PK-M)基因。蛋白质在正常细胞被称为PK-M1生产版本,而癌细胞产生的一个称为PK-M2。
PK-M2高度表达的范围广泛的癌细胞。它使癌症细胞葡萄糖消耗远远超过正常,在使用小的能量。相反,其余的用于制造更多的材料来建造更多的癌细胞。
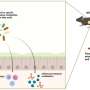
PK-M1和PK-M2产生互斥manner-one-at-a-time,从相同的基因,称为机制可变剪接。当一个基因的DNA被复制到信使分子称为信使rna,中间模板制造蛋白质,细胞机器叫做剪接体剪切并粘贴不同的信使rna分子。
编辑的不必要的部分被称为内含子,虽然最后编码蛋白质的mRNA包含一系列的部分称为外显子贴在一起。适合的钻头PK-M1基因编码序列被称为外显子9,虽然由外显子PK-M2 10所取代。以这种方式可变剪接为细胞提供了从单个基因能够使多个蛋白质。
可变剪接的权威报告,此前监管机构发表的研究蛋白质,促进PK-M剪接机制。他的团队表明,PK-M2青睐在癌细胞的表达,这些蛋白,为PK-M1采取行动抑制剪接异构体。在今天发表的研究小组解释说,它决定目标的拼接PK-M使用反义技术,而不是目标调节的蛋白质剪接机制。
使用一组反义寡核苷酸(ASOs),少量修改DNA mRNA结合目标,他们筛选新的剪接监管元素PK-M基因。他们的想法是,一个或多个ASOs RNA将绑定到一个地区的重要外显子剪接的10和显示,网站通过阻止的外显子剪接10发生。
的确,这是发生了什么事。“我们发现我们可以迫使癌细胞正常同种型,PK-M1,“总结报告。事实上,一群强有力的ASOs被发现,绑定到一个未知的外显子10增强子元素,即。,一个元素使PK-M2异构体的表达,从而防止其识别splicing-regulatory蛋白质。这启动了开关,青睐PK-M1同种型。
当他们然后故意针对PK-M2镇压的同种型细胞来源于胶质母细胞瘤,一种致命的脑癌,所有的细胞死亡。他们通过什么是被称为程序性细胞死亡或apoptosis-a过程细胞关闭自己的机械和剁碎自己的DNA在一种细胞自杀。
为什么细胞死亡当PK-M2压抑:研究小组发现这不是由于随之而来的PK-M1(细胞存活,即使额外PK-M1介绍)。相反,它是PK-M2的损失同种型这是与癌细胞的死亡有关。这是如何工作的还不清楚,但一个主题的调查报告实验室。
下一步将考虑他们的麻生太郎试剂癌症的小鼠模型,看看他们的行为一样。虽然有一些技术和方法论的障碍需要克服,报告很乐观。
“PK-M2优先表达的癌细胞,所有类型的癌症的一般功能的一个关键开关新陈代谢,”他说。因此针对PK-M2使用ASOs的可变剪接机制有可能成为癌症治疗与许多应用程序。