研究人员发现驱动转移性前列腺癌的新途径
高浓度的细胞周期蛋白D1b可以作为一种新型生物标志物的致命的前列腺癌转移性疾病患者,根据临床前研究发表之前,打印在12月21日临床研究杂志Kimmel癌症中心的研究人员在杰斐逊。
凯伦·e·克努森为首的集团,博士,教授,希拉里Koprowski椅子,癌症生物学、泌尿外科放射肿瘤学托马斯杰弗逊大学副主任在关注基础科学发现,细胞周期蛋白D1b,细胞周期调节细胞周期蛋白的一种变体D1a,功能独立于细胞周期促进转移的早期和晚期前列腺癌。
相反,细胞周期蛋白D1b,但不是细胞周期蛋白D1a,调节一个大基因网络,研究人员发现,与雄激素受体(AR)合作信号显示燃料转移性前列腺癌的进展在多个模型。
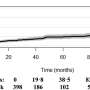
研究表明,细胞周期蛋白D1b表达升高在前列腺癌的早期阶段(在30%的原发性疾病),和研究人员已经证明,这在后期出现的更为频繁castration-resistant前列腺癌:80%。
细胞周期蛋白D1b表达式也高度相关的基因SNAI2 pro-metastatic(弹头),该集团认定为受细胞周期蛋白之间的合作信号D1b和基于“增大化现实”技术。
“大量临床和临床前研究有效地证明了基于“增大化现实”技术的信号对发展至关重要转移性疾病的基于“增大化现实”技术的目标,但我们的知识可以引起转移性表型是有限的,”努森博士说。“我们的数据描述相声之间的细胞周期和基于“增大化现实”技术可以重建基于“增大化现实”技术的信号增强基因的表达,引起轴转移早期和阉割抗前列腺癌模型。”
“我们发现,细胞周期蛋白D1b可以直接促进基于“增大化现实”技术的相关基因的表达SNAI2(弹头),这极大地提高了转移事件软组织在动物模型中,”她补充道。
转移性前列腺癌去势抵抗代表最致命的一种疾病,它就出现在AR激活尽管继续激素疗法。
软组织转移到肝脏和肺部代表一个特别积极形式的前列腺癌,其存在为减少预测前列腺癌患者的生存时间。
目前,没有知识是如何这些转移事件发生,和识别途径和生物标志物的致命事件可以前列腺癌患者中受益。
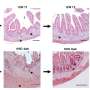
使用各种体外和体内模型,研究人员发现,蛞蝓提高细胞在软组织的能力,导致肝脏和肺转移的发生率更高。
由于无法管理基于“增大化现实”技术的信号在转移性前列腺癌去势抵抗,蛞蝓驱动路径可以杠杆大幅限制软组织转移的发生率,改善病人的发病率和死亡率,研究者认为。
”识别的基于“增大化现实”技术驱动的途径调解转移发展代表一个重大飞跃在我们试图有效地管理前列腺癌进展,”努森博士说。“细胞周期蛋白D1b和蛞蝓可能可以用作生物标记来识别患者转移的风险增加,并将最终为我们提供小说《制药”目标的下游AR和蛞蝓可以利用大大降低这些致命的转移性肿瘤的发病率。”