干细胞的方法显示了杜氏肌萎缩症的承诺
研究人员表明,移植的干细胞来自正常老鼠老鼠模型的血管进入心脏的病理与杜氏肌肉营养不良症(DMD)防止心脏功能的下降与模式有关。
他们的发现发表在《华尔街日报》干细胞转化医学。
杜氏肌萎缩症是一种遗传性疾病肌营养不良蛋白基因突变引起的,一种蛋白质,这种蛋白质锚合同时肌肉细胞。没有抗肌萎缩蛋白,肌肉收缩撕裂细胞膜,导致细胞死亡。失去的肌肉细胞必须再生,但随着时间的推移,疤痕组织取代了肌肉细胞,引起的肌肉无力和心问题的典型模式。
美国疾病控制和预防中心估计,每3500 DMD影响一个男性。这种疾病在男性更为普遍,因为肌营养不良蛋白基因突变发生在X染色体上;男性有一个X和一个Y染色体,所以男性的这种突变模式,而女性有两个X染色体,必须有突变在他们两人的疾病。雌性的突变X染色体有时发展肌肉无力,心脏问题,并可能将突变传递给他们的孩子。
尽管医学进步扩展DMD患者的寿命从十几岁或20岁到30岁出头,疾病损害心脏和隔膜仍然限制了它们的寿命。
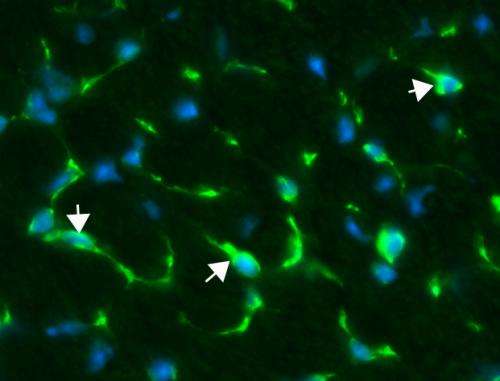
“患扩张型心肌病患者的近100%,削弱了心脏扩大的钱伯斯血液无法正常被泵到全身,伊利诺伊大学比较生物科学教授苏珊Berry-Miller说,他领导了这一研究。“现在,医生治疗心脏病的症状给患者药物来延长心脏功能,但这不能替换丢失或受损细胞,”她说。
在新的研究中,研究人员将干细胞注射称为aorta-derived mesoangioblasts (ADM)的心dystrophin-deficient老鼠作为人类DMD模型。ADM干细胞抗肌萎缩蛋白基因的工作副本。
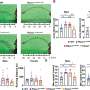
这种干细胞疗法预防或延迟心脏问题在老鼠身上没有已经表现出的功能或结构缺陷典型杜氏肌肉营养不良症,研究人员报告。
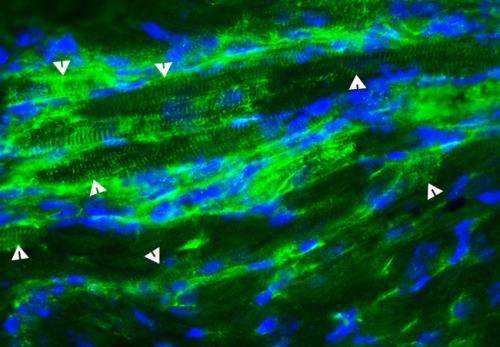
Berry-Miller和她的同事还不知道为什么功能性利益发生,但提出了三个潜在的机制。他们观察到的一些注射干细胞成为新的心肌细胞,表达缺乏肌营养不良蛋白的蛋白质。治疗也引起现有心脏干细胞分裂,成为新的心肌细胞和干细胞刺激新血管的形成。目前尚不清楚哪一个影响负责延迟心肌病发病,Berry-Miller说。
“这些vessel-derived细胞可能适合使用治疗,但更重要的是给我们新的潜在治疗靶点研究结果,这可能不使用直接激活细胞注射到病人,如ADM在当前的研究中,“Berry-Miller说。“激活干细胞已经存在于身体修复组织会避免潜在的需求之间找到一个匹配的捐献者和接受者和潜在抑制干细胞的病人。”
尽管令人鼓舞的结果表明干细胞产生功能性利益当管理在DMD老鼠心脏病理学出现之前,函数的下降在老鼠已经显示扩张型心肌病的特点。这些特征之一是肌肉组织和结缔组织的替换,称为纤维化。
Berry-Miller说,这种差异可能发生由于干细胞降落在纤维化的口袋里,而不是在肌肉组织。干细胞可能会成为成纤维细胞产生更多的结缔组织,增加疤痕,使心脏功能恶化。这表明干细胞插入的时间的增加起着至关重要的作用心脏功能在老鼠身上缺乏肌营养不良蛋白的蛋白质。
她仍乐观地认为,这些结果提供一个踏脚石向新的人类DMD患者临床指标。
“这是唯一的研究到目前为止一个功能性利益从dystrophin-deficient心脏干细胞,观察或内源性的地方干细胞心中已经观察到产生新的肌肉细胞取代那些迷失在DMD,所以我认为它开辟了一个新的领域专注于DMD的临床前研究,”Berry-Miller说。
进一步探索