抑制蛋白质可能阻止阿尔茨海默病进程
由美国国立卫生研究院资助的科学家们发现了一种潜在的策略,可以开发治疗阿尔茨海默病的治疗方法。它的原理是通过阻断一种名为CD33的鲜为人知的调节蛋白的活性,清除积聚在患者大脑中的有毒碎片。
马萨诸塞州总医院和哈佛大学的Rudolph Tanzi博士解释说:“过多的CD33活性似乎通过阻止支持细胞清除有毒斑块来促进晚发性阿尔茨海默氏症,有毒斑块是该疾病的关键风险因素。”Rudolph Tanzi博士是NIH国家精神卫生研究所(NIMH)和国家衰老研究所(NIA)的受助人。“未来阻碍CD33在大脑中的活动的药物可能有助于预防或治疗这种疾病。”
Tanzi和他的同事在2013年4月25日的杂志上报告了他们的发现神经元.
NIMH主任Thomas R. Insel博士说:“这些结果揭示了一种以前未知的、潜在的强大机制,可以保护神经元免受破坏性毒性和炎症的伤害。“鉴于越来越多的证据表明,大脑疾病在分子水平上有重叠,了解阿尔茨海默病的这种工作方式也可能为研究其他精神疾病提供见解。”
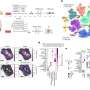
2008年,Tanzi和他的同事们发表了一份关于阿尔茨海默氏症影响家族的报告,CD33基因的变异被认为是最大的全基因组拉网的四个主要嫌疑人之一。已知该基因可以制造一种调节免疫系统的蛋白质,但它在大脑中的功能仍不清楚。为了发现它是如何导致阿尔茨海默氏症的,研究人员采用了人类遗传学、生物化学和人类脑组织、小鼠和细胞实验。
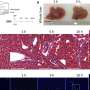
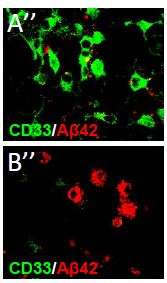
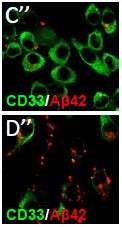
他们发现,在迟发性阿尔茨海默病(最常见的一种阿尔茨海默病)患者死后大脑中,一种叫做小胶质细胞的支持细胞中有CD33的过度表达。小胶质细胞表面的CD33蛋白越多,大脑中积累的β -淀粉样蛋白和斑块(破坏性碎片)就越多。此外,研究人员还发现,遗传了一种CD33基因的人,其大脑小胶质细胞表面的CD33数量明显减少,β -淀粉样蛋白也较少。
在基因改造为CD33低表达或缺乏的小鼠中,β -淀粉样蛋白和斑块的大脑水平也显著降低。这些动物体内的小胶质细胞更有效地清除了碎片,研究人员追踪到细胞表面的CD33水平。
证据还表明,CD33与小胶质细胞中的另一种阿尔茨海默病风险基因合作,以调节大脑中的炎症。
这项研究结果——以及最近一项大鼠研究的结果,复制了人类疾病的许多特征——进一步支持了流行理论,即β -淀粉样斑块的积累是阿尔茨海默病病理的标志。最近其他相互矛盾的证据表明,这些假定的罪魁祸首可能反而发挥了保护作用,这引发了该领域的骚动。
由于小胶质细胞中CD33活性的增加会损害晚发性阿尔茨海默氏症患者的β -淀粉样蛋白清除,Tanzi和他的同事们现在正在寻找能够穿过血脑屏障并阻断它的药物。