新的线索揭示了阿尔茨海默病的根源
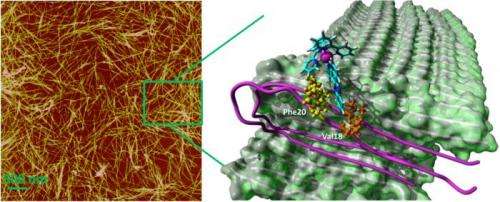
莱斯大学和迈阿密大学的科学家们已经弄清楚了莱斯大学设计的合成分子是如何附着在被认为是导致阿尔茨海默病的淀粉样肽原纤维上的。他们的发现可能为阻止甚至逆转这种潜在疾病的治疗指明道路。
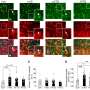
金属二吡啶苯那嗪钌当细胞无法破坏错误折叠的蛋白质形成原纤维时,分子会强烈地结合在口袋上。在a下兴奋时分光镜,分子发光,这表明原纤维的存在。莱斯大学的研究人员已经知道了这一点,但直到现在,这个过程还是个谜。
通过结合他们在生物物理学(在莱斯大学)和计算机模拟(在迈阿密大学)方面的才能,研究人员在纤维上确定了四个这样的口袋,在那里疏水(憎水)分子可以结合。他们相信他们的工作将帮助化学家设计分子来阻止原纤维形成阿尔茨海默病患者身上发现的斑块。
由赖斯化学家Angel Martí和迈阿密化学家Rajeev Prabhakar领导的研究小组在《科学》杂志上报告了他们的研究结果美国化学学会杂志本月。
两年前,Martí和Nathan Cook(他实验室的研究生,也是这篇新论文的主要作者)将钌复合物与含有意大利面样淀粉样原纤维的溶液结合在一起。这些复合物本身不会发光,但当它们与淀粉样蛋白纤维连接时,它们可以被一种波长的光触发,发出另一种波长的光;这有助于研究人员“看到”原纤维。
库克说,这种追踪淀粉样蛋白的能力是向前迈出的一大步,但为什么这些复合物会附着在原纤维上,这个问题还没有解决。
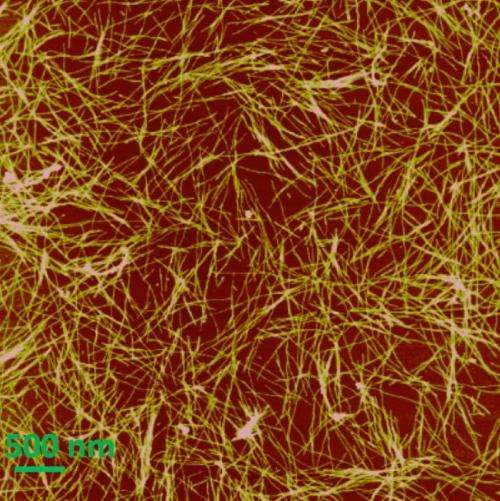
“我们没有办法弄清楚,因为我们的实验技术无法识别结合位点,”他说。“(用于分析蛋白质的)标准是使材料结晶,然后使用x射线确定所有物质的位置。淀粉样蛋白的问题是原纤维不是均匀的,你不能使它们结晶。你只会得到一个无定形的肿块。”
但当专门研究淀粉样蛋白的理论和计算化学家普拉巴卡联系Martí并建议合作时,一扇门打开了。“我们都知道对方在研究淀粉样蛋白,”Martí说。“我们能够弄清楚有多少β淀粉样蛋白单体(可以相互结合的分子)必须聚集在一起形成原纤维,而他则模拟了相互作用。当我们把所有的数据放在一起时,我们找到了一个完美的匹配。”
“基本上,我们从这个模型中学到,我们需要两个单体来形成一个结合位点,”马蒂说。“钌络合物结合的缝隙是完全疏水的,与络合物一样。它们都不想暴露在水里,所以当它们找到彼此时,它们别无选择,只能走到一起。事实证明,这正是开启这种化合物的光致发光反应所需要发生的事情。”
Martí表示,测试不同浓度的钌络合物单体有助于他们确定,平均略多于两个单体就足以达到“电灯开关”的效果。Prabhakar的分析发现,钌络合物可以在聚集单体的四个特定位置结合:两个在单体倾向于相互结合的末端,两个在中间。
普拉巴卡说:“这是一个复杂的系统,我们努力尝试,使用了各种计算技术。”“最后,我们惊奇地发现我们的结果与Martí实验室进行的实验完全一致。”
研究人员将末端的位置称为“A和B”,中间的位置称为“C和d”。疏水的A和B位点仅存在于原纤维的边缘,这限制了它们与复合物的接触,Martí说。“但是有很多C和D网站,”他说。“这就解释了为什么钌复合物不能抑制原纤维的聚集。该系统似乎更倾向于在末端结合另一种单体,而不是钌络合物。
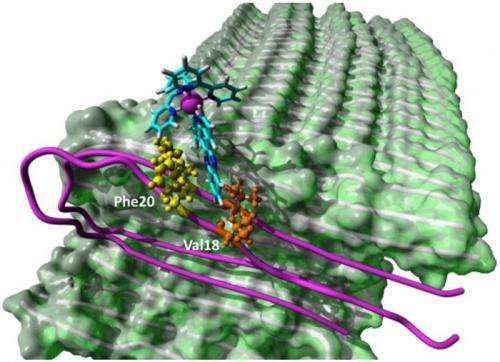
“但现在我们了解了机理,我们可以设计出更多的疏水复合物,这些复合物可以与纤维末端紧密结合,防止纤维进一步伸长,”他说。
库克说:“有各种各样的方法可以对它进行调整,可能会破坏装订口袋。”
他说,新发现之外还有更多的挑战。新的研究表明,有毒的低聚物可能由淀粉样蛋白原纤维的形成催化。“我们也许能够通过结合来阻止这些低聚物种的形成钌配合物到表面,这将完全改变表面的化学性质原纤维Martí说。“这些是我们现在真正感兴趣的事情。”
该论文的共同作者是莱斯大学本科生克里斯蒂娜·卡桑普斯和迈阿密研究生穆罕默德·奥兹比尔。
韦尔奇基金会、国家科学基金会和佛罗里达州卫生部的詹姆斯和埃丝特·金生物医学研究项目支持了这项研究。bob88体育平台登录
更多信息:pubs.acs.org/doi/abs/10.1021/ja404850u