多变的疾病可以解释变量出现的神经退行性疾病的蛋白质
神经退行性疾病并非都是一样的。两个人患有相同疾病发病的年龄可能会经历非常不同,症状严重程度,和星座的障碍,以及不同的疾病进展率。佩雷尔曼医学院的研究人员在宾夕法尼亚大学显示一种疾病蛋白质可以变成不同的菌株和促进其他疾病的错误折叠的蛋白质在阿尔茨海默氏症,帕金森氏症和其他相关神经退行性疾病。
弗吉尼亚'李,博士学位,MBA,病理学和实验室医学教授和神经退行性疾病研究中心主任和副主任,医学博士约翰问:Trojanowski博士,博士后Jing l .郭博士和他的同事们,发现α-突触核蛋白,蛋白质形成的神经元聚集结块帕金森症患者,至少可以存在于两个不同的结构形状,或“压力”,团成纤维,尽管完全相同化学成分。
这两个菌株有不同的能力促进原纤维形成正常的α-突触核蛋白,以及蛋白质τ神经原纤维缠结,形成阿尔茨海默氏症患者。
重要的是,这些不是静态的α-突触核蛋白菌株;他们以某种方式进化,这样纤维最初不能促进τ缠结获得这种能力经过多轮的纤丝在试管中形成“播种”。
该发现发表在7月3日出版的细胞。
演变错误折叠的蛋白质中发现重叠的神经退行性疾病
τ蛋白和α-突触核蛋白团是单独的疾病——阿尔茨海默氏症和帕金森氏症的标志,分别。然而,这些两种蛋白质往往发现纠缠在病变患者的大脑可能显化这两个障碍的症状。
对于这一现象的一个可能的解释的阿尔茨海默氏症和帕金森氏症疾病的病理在同一病人是一个全球性的中断蛋白质折叠。但是,郭和李表明,α-突触核蛋白菌株之一原纤维实际上不能促进τfibrillization演变成另一个压力,可以有效地使τfibrillize培养神经元,虽然两菌株在氨基酸序列是相同的水平。郭和李称为构象开始“应变,”和构造演化而来,“应变b”
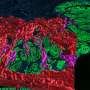
郭找出A和B不同,表明两种折叠成不同的形状,显示他们的微分反应性抗体和敏感性protein-degrading酶。两株不同的能力促进τfibrillization鼠脑病理,模仿培养细胞的结果。当验尸的帕金森患者的大脑分析,研究小组发现至少有两种不同的形式的病态的α-突触核蛋白。
李和她的团队推测,在人类中,α-突触核蛋白聚集可能会改变他们的形状从细胞到细胞(就像一个立方体的橡皮泥日前形成一个球体),可能发展卷入其他蛋白质如τ的能力。这个过程,反过来,理论上可以产生不同类型的α-突触核蛋白病理观察到不同大脑区域的帕金森症患者。
虽然需要进一步的研究来证实和扩展这些发现,他们有潜在的重大影响病人患有帕金森症等神经退行性疾病。例如,李解释说,他们可以占的异质性在帕金森病。不同的菌株有病态的α-突触核蛋白可以促进不同类型的α-突触核蛋白聚集的形成,可能会或可能不会引起τ病理学在大脑不同区域和不同的病人。反过来,可以解释为什么一些帕金森患者,例如,别人只运动能力损伤而经验最终发展认知障碍。
这些发现也有潜在的治疗意义,李说。认识到病态的α-突触核蛋白可以存在于不同的形式,是与不同的障碍,研究人员现在可以选择性的目标一个或另一个,或两个,例如strain-selective抗体。
“我们发现开辟了新的领域发展疗法,特别是免疫疗法,对帕金森氏症和其他神经退行性疾病,”李说。
更多信息:郭京l . et al。“不同α-Synuclein菌株不同促进神经元的τ夹杂物。”细胞2013年7月3日。doi: 10.1016 / j.cell.2013.05.057