科学家确定ALS疾病机制
研究人员将突变绑在导致肌萎缩性侧索硬化症(ALS)和其他神经退行性疾病的基因中,以与包括神经元在内的细胞中某些蛋白质和相关分子的有毒积累。该研究最近发表在《科学杂志》上细胞,提供了一种针对这些毁灭性疾病的治疗方法的新方法。
圣裘德儿童研究医院和科罗拉多大学博尔德分校的科学家领导了这项工作。
这些发现提供了第一个证据,表明一个名为VCP的基因在蛋白质和RNA分子的分解和清除中起作用,这些蛋白质和RNA分子积聚在称为RNA颗粒的临时结构中。RNA执行各种重要细胞功能, 包含蛋白质产生。RNA颗粒支持RNA的正确功能。
在ALS和相关退化性疾病,组装和清除RNA颗粒的过程受损。与颗粒相关的蛋白质和RNA通常在神经中积聚细胞患者。这项研究表明,VCP中的突变如何有助于该过程和神经退行性疾病。
“结果对解释各种链接的过程有很长的路要走神经退行性疾病,包括ALS,额颞痴呆和大脑相关疾病,肌肉和骨骼被称为多系统蛋白质病。科罗拉多大学化学与生物化学系和霍华德·休斯医学研究所(HHMI)的发展神经生物学。
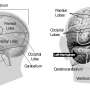
ALS,也称为Lou Gehrig氏病,每年被诊断出约5,600名美国人进行性恶化的神经细胞在控制运动的大脑和脊柱中,包括呼吸。没有有效的治疗方法,死亡通常在五年内发生。
帕克说:“这项研究的优势在于,它提供了一个关于不同遗传突变如何影响压力颗粒的统一假设,这表明理解压力颗粒动力学及其如何被操纵可能对治疗这些疾病有益。”
泰勒实验室的早期工作将VCP中的突变确定为ALS和相关多系统蛋白质病的原因。然而,到目前为止,这些错误如何引起疾病。最新发现出现在6月20日的第20期中,并在8月15日发表的评论文章中得到了强调细胞。
泰勒实验室的博士后研究员里贾纳·玛丽亚·科洛蒂斯(Regina-Maria Kolaitis)博士说,这项研究还将VCP突变与RNA调节的破坏有关,这与神经退行性疾病的进展有关。她和罗斯·布坎(Ross Buchan)博士是帕克实验室的博士后研究员,是第一作者。
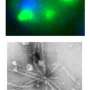
这项工作集中在一类称为应激颗粒的RNA颗粒上。它们是由蛋白质和称为mRNA的RNA分子形成的,该蛋白会响应胁迫而在细胞质中积聚。压力细胞不想浪费能量产生不必要的蛋白质。应力颗粒是一种机制细胞来停止产生,直到细胞环境正常化为止,这是应力颗粒通常溶解的。
在胁迫颗粒中发现的蛋白质包括调节基因活性的RNA结合蛋白,例如TDP-43,FUS,HNRNPA1和HNRNPA2B1。这些蛋白质中的突变也会引起ALS和相关疾病。
Kolaitis说:“ VCP在细胞中具有许多功能,但它不是RNA结合蛋白,直到现在,它与应力颗粒或RNA处理还没有连接。”“这项研究为疾病过程提供了一个新的窗口,强调了VCP在保持细胞健康方面的作用。”
对于这项研究,研究人员使用酵母来识别影响应激颗粒形成和行为的125个基因网络。CDC48是在网络中起着核心作用的基因之一,其功能像酵母中的VCP一样。此外,鉴定出的许多基因都参与了一个称为自噬的过程,该过程用来分解和回收不需要的分子,包括蛋白质。
研究人员在酵母和哺乳动物细胞中工作,表明应力颗粒被自噬清除,当VCP突变时停滞不前。研究人员还报告说,在CDC48或VCP突变后积累的应力颗粒。
“这项工作表明,激活自噬以帮助摆脱细胞的压力颗粒泰勒说:“为神经退行性疾病治疗提供了一种新的方法。”
进一步探索