阿尔茨海默氏症:新发现蛋白病理损害RNA剪接
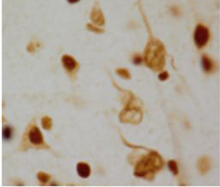
挪开,斑块和神经元纤维缠结。
埃默里大学医学院的研究人员的阿尔茨海默病研究中心已经确定了一个以前从未发现过的病理类型的老年痴呆症患者的大脑中。
这些tangle-like结构出现在早期阿尔茨海默氏症和其他没有发现神经退行性疾病如帕金森症。
这些缠结截然不同的是,他们吸收蛋白质参与RNA拼接,教学信息的过程基因剪切和粘贴在一起。研究人员表明,这些缠结与普遍的出现改变RNA拼接在阿尔茨海默氏症的大脑相比,健康的大脑。
这一发现可能会改变科学家对疾病的发展和进步,通过解释基因与阿尔茨海默氏症造成的影响,并可能导致新的生物标志物,诊断方法和治疗方法。
结果发表在美国国家科学院院刊》上,早期版本。
“我们非常惊讶的发现改变蛋白质负责RNA拼接在阿尔茨海默氏症,这可能对疾病机制产生重大的影响,”艾伦·利维说,医学博士,博士,埃默里大学医学院的神经病学主任埃默里自抗扰控制器。
“这是一个全新的领域,”詹姆斯说啦,医学博士,博士,埃默里大学医学院的神经病学副教授和认知神经学项目的主任。“许多阿尔茨海默氏症调查人员看着这种疾病如何影响可变剪接个人的基因。我们的研究结果表明全球RNA加工变形发生。”
这项研究是由Drs。利维,a音的唱名,Junmin彭博士曾是艾莫利大学的遗传学副教授,他现在是在圣犹大儿童研究医院教员。他们得到了肯塔基大学的合作者,拉什大学,华盛顿大学以及同事埃默里。
积累斑块和神经元纤维缠结的老年痴呆症患者的大脑中首次观察到的一个多世纪以前。调查这些病理结构的蛋白质被疾病的研究中心。
大多数实验治疗阿尔茨海默氏症旨在抑制β-淀粉样蛋白,一个明显毒性蛋白质淀粉样斑块的主要组件的片段。其他方法目标蛋白质的异常积累τ神经原纤维缠结。然而,阿尔茨海默氏症的发展不仅仅是解释为淀粉样蛋白和τ病态,啦说。
“两个人可能港类似的大量的淀粉样斑块和τ缠结在他们的大脑,但一个可能完全健康,而其他可能失忆、痴呆严重,”他说。
这些差异导致埃默里调查人员采取“正本清源”蛋白质组学方法,编目的蛋白质不溶性存款老年痴呆症患者的大脑中。
“阿尔茨海默氏症领域非常关注淀粉样蛋白和τ,我们今天想用蛋白质组学技术全面,公正的方法,”利维说。
团队确认36蛋白质detergent-resistant存款更丰富的老年痴呆症患者的大脑组织。这个列表包括通常的嫌疑人:τ和β-淀粉样蛋白。名单上还有几名“U1 snRNP”蛋白质,参与RNA拼接。
这些U1蛋白质通常出现在正常细胞的细胞核,但在阿尔茨海默氏症的大脑他们积累tangle-like结构。不溶性U1蛋白质积累在轻度认知障碍(MCI)患者样本,阿尔茨海默氏症的前兆阶段,但U1病理未见其他脑部疾病检查。
根据乍得黑尔斯,医学博士,该研究的主要作者之一,”U1聚合发生在疾病的早期,U1缠结可以看到独立的τ病理学。在某些情况下,我们看到的积累不溶性U1蛋白质不溶性τ的出现之前,表明这是一个非常早期的事件。”
对于大多数基因,从DNA RNA宣读后(转录),一些RNA必须拼接。当大脑细胞积累的U1蛋白质,这可能意味着拼接受损的过程。为了测试这个,埃默里团队研究RNA从老年痴呆症患者的大脑。RNA从健康的大脑相比,更多的RNA从阿尔茨海默氏症的大脑是unspliced样本。
这一发现可以解释多少基因与阿尔茨海默氏症的影响。在细胞,U1 snRNP扮演多个角色处理RNA包括可变剪接的过程中,由一个基因可以说明两个或两个以上的蛋白质。
“U1功能障碍可能产生的变化影响许多基因的RNA加工或特定变化影响几个关键基因是重要的在阿尔茨海默氏症,”啦。“理解这样一个基本过程的中断几乎肯定会识别了解阿尔茨海默氏症的新方法和新方法治疗病人。”