“个性化”治疗大脑目标特定的基因突变导致痴呆和肌萎缩性侧索硬化症
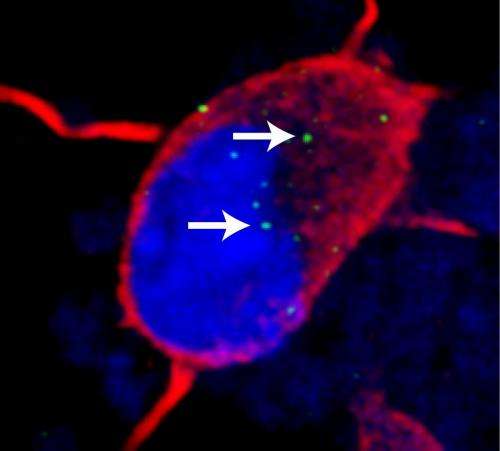
约翰霍普金斯大学的科学家们已经开发出新药——至少在实验室盘出现制止破坏大脑的基因突变的影响在某些形式的两种不可治愈的疾病,肌萎缩性脊髓侧索硬化症(ALS)和痴呆。
他们发现通过使用神经元他们创建的干细胞被称为诱导多能干细胞(iPS细胞),这是源自ALS患者的皮肤有基因突变干扰的过程正常神经元功能所需的蛋白质。
“努力治疗神经退行性疾病的所有临床试验故障率最高,”Jeffrey d . Rothstein说,医学博士博士,神经病学和神经科学教授约翰·霍普金斯大学医学院的领袖和在线杂志上描述的研究神经元。“但是这个ip技术,我们认为我们可以目标精确子集的一个特定的突变和患者成功。大脑的个性化治疗,只是,在癌症已经完成,但尚未在神经学。”
科学家在2011年发现,超过40%的患者一种遗传形式的ALS和至少10%的患者non-inherited零星的形式C9ORF72基因的突变。突变也经常发生在额颞叶痴呆患者,早形式的痴呆后阿尔茨海默氏症。同样的研究似乎解释为什么有些人开发ALS和痴呆的同时,在一些家庭里,一个孩子可能发展ALS而另一个可能发展痴呆。
C9ORF72基因的一个正常的人,有多达30重复的一系列六DNA字母(GGGGCC);但在患有遗传故障,字符串可以重复上千次。Rothstein,约翰霍普金斯大学脑科学研究所的主任罗伯特·帕卡德ALS研究中心,用他的大银行的诱导多能干细胞的ALS患者识别几个C9ORF72突变,然后尝试用算出的机制的“重复”是导致脑细胞死亡ALS的特征。
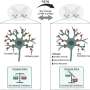
Rothstein说,在一系列的实验中,他们发现“诱导多能性”细胞的突变,利用DNA蓝图的过程中RNA,然后产生蛋白质是中断。通常情况下,RNA结合蛋白促进RNA的生产。相反,在iPS神经元C9ORF72突变,RNA由重复GGGGCC字符串成团,影响了大局,像捕蝇纸和抓住的极其重要的RNA结合蛋白,包括一个称为ADARB2,适当的生产所需的其他许多细胞RNA。总的来说,C9ORF72突变使细胞产生异常大量的其他正常细胞rna,非常灵敏的压力。
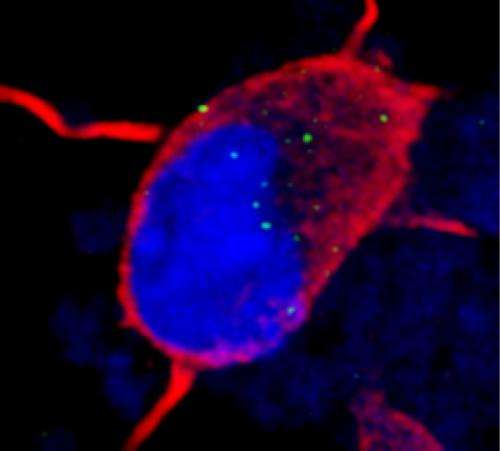
应对这种效果,研究人员开发了一系列化合物的定位问题。这种化合物表现得像一个相匹配的涂料GGGGCC重复像维可牢,防止flypaper-like重复诱饵吸引,使rna结合蛋白正确地做它的工作。
Rothstein说伊希斯药品帮助开发的许多化合物和学习,通过与约翰霍普金斯大学团队密切合作,可以开始测试它在人类ALS患者C9ORF72突变在未来数年。与美国国立卫生研究院的合作,计划已经展开,开始确定一组患者C9ORF72突变为未来的研究。
丽塔解决博士,约翰霍普金斯大学的神经病学助理教授和这项研究的研究员,说没有iPS技术,团队会有一个艰难的时间学习C9ORF72突变。“通常情况下,研究者工程师啮齿动物突变他们试图模仿人类的问题研究然后研究他们,”她说。“但是多个重复的性质,几乎不可能。”The iPS cells did the job just as well or even better than an animal model, Sattler says, in part because the experiments could be done using human cells.
“一个iPS细胞系可以使用有效和快速理解疾病机制和治疗发展作为一种工具,“Rothstein补充道。“现在我们需要看看我们的发现转化为有价值的治疗人类。”
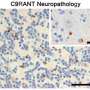
研究人员还分析了患者的脑组织C9ORF72突变ALS的去世。他们看到这束线的证据,发现许多基因改变这种突变的结果“诱导多能性”细胞也异常的大脑组织,从而表明“诱导多能性”细胞可以是一个忠实的工具来研究人类疾病和探索有效的治疗方法。
在未来,科学家们将着眼于ALS患者的脑脊髓液C9ORF72突变,寻找蛋白质被发现在流体和“诱导多能性”细胞。这些可能为发展铺平道路标记,可以研究临床医生治疗是否工作一旦搬到药物治疗临床试验。
肌萎缩性侧索硬化症,有时被称为卢伽雷氏症,命名为洋基棒球大去世,破坏神经细胞在大脑和脊髓控制随意肌运动。神经细胞消瘦或死亡,不再能够将消息发送到肌肉,最终导致肌肉弱化,抽搐和无法移动胳膊、腿和身体。发作通常是50岁左右和死亡通常发生在三到五年的诊断。大约10%的病例是世袭的。没有治疗ALS,只有一个fda批准的药物治疗,刚刚小效应减缓疾病进展和增加生存,Rothstein笔记。
更多信息:神经元唐纳利等人:“毒性RNA从ALS / FTD C9ORF72扩张是由反义干预减轻。”dx.doi.org/10.1016/j.neuron.2013.10.015