研究小组建立了新的“关闭开关”来关闭神经活动
2005年,斯坦福大学的一位科学家发现了如何利用微生物中的特殊蛋白质将电流传递到神经元中,从而通过光脉冲来开关脑细胞。
从那时起,世界各地的研究团队使用了科学家Karl Deisseroth医学博士称为“光遗传学”的技术,不仅研究脑细胞,还研究心脏细胞、干细胞和生物学中大量可以被电信号(离子穿过细胞膜的运动)调节的细胞类型。
光遗传学为研究人员提供了强大的调查技术,以加深他们对动物模型中生物系统设计和功能的理解。但第一代光遗传学有一个缺点:它的光敏蛋白能有效地打开细胞,但关闭细胞的效果较差。
现在,在一篇论文中,经过多年的努力,戴瑟罗斯的团队重新设计了他们的光敏蛋白,使细胞比以前更有效地关闭。这篇论文将于4月25日发表科学.
“这是我们和该领域的其他人已经寻找了很长时间的东西,”该论文的高级作者、生物工程、精神病学和行为科学教授戴瑟罗斯说。
Thomas Insel医学博士,国家心理健康研究所主任,资助了这项研究,他说这种改进的“关闭”开关将帮助研究人员更好地理解涉及行为、思考和情感的大脑回路。
Insel说:“Deisseroth团队的最新发现正是奥巴马总统在一年前启动BRAIN计划时所设想的那种神经技术。”“它创造了一个强大的工具,允许神经科学家在任何特定的电路中以毫秒的精度施加刹车,超出了任何现有技术的能力。”
在这一发展的背后,Deisseroth实验室进行了多年的基础实验,以发现一个关键的光遗传学“开启”开关如何如此有效地刺激细胞,然后系统地重新设计这个分子机器,将其转变为一种全新的“关闭”开关。
“这是科学和工程界面上的一个复杂故事,”戴瑟罗斯说,他也是斯坦福大学D.H.陈教授和霍华德休斯医学研究所的研究员。
蛋白质是生命的机器。这些巨大的分子是由被称为氨基酸的小分子构成的。就像许多乐高积木一样,氨基酸结合在一起形成蛋白质,然后这些蛋白质相互作用,完成生命中每一个奇妙的任务,从控制我们指尖的肌肉到激发我们大脑中的神经元。通过光遗传学,戴瑟罗斯的实验室将一种被称为微生物视蛋白的蛋白质家族变成了一种研究工具。这个故事已经在其他地方流传过,但结果是,光遗传学允许科学家通过插入动物模型大脑的薄纤维发射激光脉冲。这些光脉冲触发视蛋白传递刺激的正离子流或抑制的负离子脉冲,以高精度和特异性控制行为。
随着越来越多的研究人员接受光遗传学,许多关于兴奋性和抑制性视蛋白的发现都有了。但戴瑟罗斯和其他科学家开始注意到,刺激比抑制更有效。因此,他试图通过更深入地研究兴奋性视蛋白只传递正离子的机制,为开发新的抑制工具奠定基础。
从概念上讲,兴奋性视蛋白的作用机制很简单。光激活导致视蛋白打开一个穿过细胞膜的通道;然后正离子流过这个通道,就像水流过花园软管一样。利用这种通道机制,Deisseroth和他的合作者在2008年制造了兴奋性视蛋白的改良版本。他们称之为阶梯功能视蛋白。一个光脉冲就能打开这些开关,保持频道畅通。这使得离子可以继续流动,即使在关灯后也能保持细胞处于兴奋状态。由这些阶梯功能视蛋白产生的离子的连续流动也使细胞对光的敏感性提高了许多倍。这使得科学家可以在不使用光纤穿透组织的情况下刺激动物模型大脑深处的神经元。
与此相反,抑制性视蛋白均无通道作用。它们都是“泵”,对于每一个进入的光子,只能让一个离子穿过膜,这更像水枪而不是花园软管。每一个进来的光子就像扣动扳机来传递一个负离子。但它需要另一个光子,或触发拉力,来传递下一个负离子,等等。就每光子移动的离子而言,这种泵浦机制的效率低于通道机制。也不可能设计抑制视蛋白保持开放状态。因此,进行实验需要更多的干扰性光的使用。最后,抑制泵的工作方式与正常的抑制机制不同大脑细胞.正常的机制使神经元膜渗漏——就像带有针尖的水球——更不易放电。所有这些因素使得视蛋白泵作为抑制剂的效率降低。理想情况下,生物工程师想要一种像通道一样起作用的抑制性视蛋白。
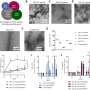
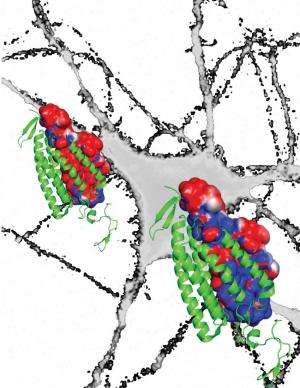
在2012年《自然》杂志的一篇文章中,Deisseroth的团队(与东京大学生物科学主任Osamu Nureki博士合作)在改善光遗传抑制的道路上迈出了一大步,他们揭示了开关通道蛋白的详细结构。这项工作表明,通道孔内的氨基酸产生了一层负电荷。这个负离子衬里吸引正离子通过细胞膜来激发细胞。这一发现指出了一种创建抑制通道的潜在策略:生物工程视蛋白以创建正氨基酸的内层,以吸引负(抑制)离子(如氯离子)流入细胞。
从那时起,Deisseroth的团队又花了大约两年的时间,由Andre Berndt博士和Soo Yeun Lee博士领导,他们是生物工程博士后学者,也是这篇论文的主要作者。为了创造这种新的衬里,斯坦福大学的研究小组重新设计了2012年实验中的兴奋性通道视蛋白,改变了蛋白质大约300个氨基酸中的9个。当被光触发时,这种新的生物工程蛋白现在打开了一个由更多正电荷排列的通道氨基酸,从而吸引了负(氯离子)的流动来抑制活性。这创造了一种微生物视蛋白,能够提供强大的抑制通道效应。
最终,他们实现了这个项目最令人期待的目标之一,他们改变了第10个氨基酸,这使他们能够保持这个新的负通道开放——使负通道更像正通道。正如所希望的那样,这产生了一种对光敏感的抑制通道视蛋白。目标神经元在单一的、短暂的蓝光脉冲后仍保持关闭状态数分钟,这种方式在红光下立即可逆。Deisseroth将这种新的负通道称为视蛋白SwiChR。
随着斯坦福大学团队从第一次神经元微生物视蛋白实验开始的10年旅程的继续,Deisseroth预计SwiChR的长效和稳定反应将为光遗传学打开新的机会领域。
他的热情得到了瑞典隆德大学医院教授Merab Kokaia博士的响应,他利用光遗传学在啮齿动物模型上研究癫痫和其他疾病。Kokaia没有参与Deisseroth团队的新研究,他指出了新的视蛋白的主要优势:基于氯化物电导,更有效地抑制神经元活动,对光的敏感性更高,能够长时间保持开放,即使长时间没有光也能保持抑制。
Kokaia说:“这些特征可能对动物的行为研究更有用,但也可能成为药物不起作用的神经系统疾病的有效治疗选择,比如一些严重癫痫和其他过度兴奋性疾病。”“Deisseroth实验室使用的通道工程的新方法为开发新的光遗传学工具用于系统神经科学研究开辟了前所未有的前景,这将帮助我们更好地了解大脑是如何工作的。”
Charu Ramakrishnan是Deisseroth实验室的研究助理,也是这篇论文的合著者。