糖尿病易感基因调控细胞动力健康
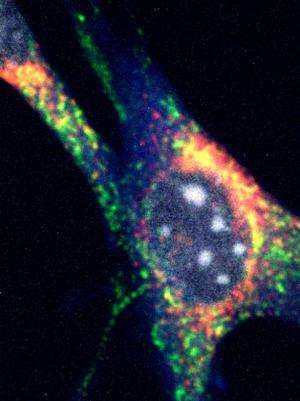
宾夕法尼亚大学佩雷尔曼医学院的研究人员领导的研究小组发现,1型糖尿病的易感基因可以调节细胞能量工厂的自我毁灭。他们将于本周在细胞.
该基因的中心通路可能是预防和控制1型糖尿病的靶点,并可能扩展到其他代谢相关疾病的治疗。
研究小组发现,这种名为Clec16a的基因在胰腺细胞中是正常葡萄糖刺激胰岛素释放所必需的。更重要的是,在Clec16a附近有基因序列变异的人,他们的胰岛细胞中蛋白质的表达减少了,因此降低了胰岛素分泌.
第一作者Scott a . Soleimanpour医学博士是联合资深作者Doris Stoffers医学博士、医学教授实验室的博士后研究员,他研究出了Clec16a在胰腺中的作用β细胞.索莱曼普尔现在是密歇根大学医学院的助理教授。Stoffers也是宾夕法尼亚大学糖尿病、肥胖和代谢研究所的成员。
细胞能量工厂(线粒体)的自我毁灭过程被称为线粒体吞噬。从字面上看,这意味着线粒体的自我吞噬,而线粒体是产生能量分子ATP的地方。胰腺内的β细胞富含线粒体,因为它们的胰岛素分泌功能是一个能量密集型过程。
线粒体吞噬包括分解和回收功能较差的旧线粒体,以构建新的线粒体。Clec16a在这种处理途径中控制β细胞功能,被认为可以预防糖尿病相关的有丝分裂。
人们对Clec16a蛋白在哺乳动物中的功能或其在疾病引发中的作用知之甚少。研究小组发现,Clec16a与一种名为Nrdp1的酶相互作用,后者通过另一种名为Parkin的蛋白质起作用。通常情况下,帕金通过最初标记不健康的线粒体进行处理来调节线粒体自噬。
胰腺特异性缺失Clec16a的小鼠线粒体异常,产生较少的ATP,这是正常β细胞功能和最终胰岛素分泌所必需的。具体来说,他们确定Clec16a的缺失会导致Parkin的增加,Parkin是有丝分裂的主要调节因子。更重要的是,研究小组发现,不健康线粒体的最终处理也存在缺陷。
“Clec16a缺失的最终结果是不健康基因的积累线粒体导致β细胞分泌的胰岛素减少,”Stoffers说。
来自隆德大学和瑞典Skåne大学医院的合著者提供了一组人类胰岛细胞,使Soleimanpour能够确定Clec16a基因附近DNA序列中的一个小的糖尿病风险变异是否直接影响了该基因的正常表达和功能。具有这种短序列变异的个体在基因中Clec16a表达减少胰岛细胞以及轻微升高的血糖。此外,利用先前发表的大型遗传数据库,研究人员可以进一步将相同的疾病相关序列变异与β细胞功能降低联系起来。由此,研究小组得出结论,在正常状态下,Clec16a控制β细胞功能,并通过控制线粒体自噬来预防糖尿病。
“2007年,我们的基因组学团队发现了第一个在全基因组搜索中发挥重要作用的基因1型糖尿病但我们不知道它的功能,”费城儿童医院应用基因组学中心主任、医学博士、联合资深作者哈康·哈康纳森(Hakon Hakonarson)说。“现在我们了解了这种基因在调节胰岛素代谢中发挥的关键作用。”
研究人员总结说,这种新型的Clec16a通路可以作为预防和控制糖尿病的靶点,并可能扩展到其他Clec16a和帕金森相关疾病的发病机制。
进一步探索










用户评论