突触总是在起跑线上
当神经元通过电信号在其内部快速传播信息时,它们通过被称为突触的特殊接触点彼此交流。化学信使物质,即神经递质,储存在突触的囊泡中。当突触变得活跃时,其中一些囊泡与细胞膜融合并释放其内容物。为了确保宝贵的时间不被浪费掉,突触总是有一些随时可以释放的囊泡处于待命状态。在高分辨率、三维电子显微镜的帮助下,马克斯·普朗克实验医学研究所的科学家们在Göttingen网站上成功地证明了这些可融合的囊泡有一个非常特殊的特征:它们早在实际融合发生之前就已经与细胞膜密切接触了。此外,研究团队还解码了促进这种对接机制运作的分子机制。
神经递质的融合囊泡细胞膜的作用涉及到众多蛋白质成分之间的密切合作,它们相互监控,确保每个“参与者”总是在正确的位置上。这被称为融合机械,这种比较是恰当的:如果钟表机构的齿轮坏了,指针就不动了。同样,错误或缺失的分子也会损害突触的运作。
在几年前进行的研究中,来自马克斯普朗克实验医学研究所的Nils Brose和他的同事JeongSeop Rhee在Göttingen网站上已经证明,在转基因小鼠中,Munc13或CAPS蛋白的所有已知基因都被关闭的情况下,突触上的信息传递存在严重缺陷。尽管在光学显微镜下观察转基因小鼠的神经元与健康小鼠的神经元并无差异,但如果Munc13缺失,神经递质的释放实际上会完全停止。Brose和Rhee的发现表明,为了能够随时对信号做出立即反应,每个突触必须保持少量“随时可释放”的可融合囊泡处于待命状态。
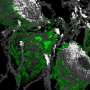
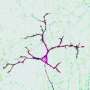
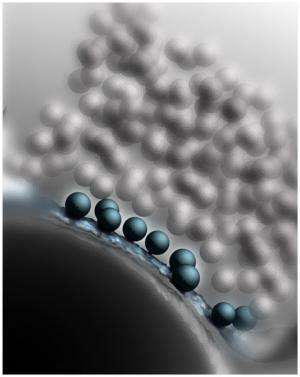
但是Munc13和CAPS是如何将囊泡转化成这种可融合的状态的呢?为了回答这个问题,Göttingen-based的科学家们对突触接触进行了尽可能细致的研究。为了做到这一点,神经生物学家Cordelia Imig和Ben Cooper使用了高压冷冻过程,他们与Brose和Rhee合作多年。这涉及到在高压下快速冻结脑组织中的神经元,这样就不会形成破坏性的冰晶,从而使细胞的精细结构得到很好的保存。用这种方法得到的样品,然后用电子断层扫描分析。使用这种方法,结构的电子显微镜图像从许多不同的角度被记录下来,这与医学计算机断层扫描所使用的过程类似。然后,这些单独的图像可以在计算机上组合成一个高分辨率的三维图像——在这个例子中是一个突触的图像(见图)。
“我们的研究结果表明,健康突触中容易释放的囊泡接触细胞膜,”库珀解释说。“然而,如果Munc13和CAPS蛋白质缺失,囊泡就无法到达活性区,并在离活性区几纳米远的地方积累。”令他们惊讶的是,研究人员还观察到,在神经末梢与Munc13和CAPS合作的SNARE蛋白也参与了这个对接过程。SNARE蛋白存在于健康突触的细胞膜和囊泡中,在神经递质释放过程中控制两细胞膜的融合。当囊泡接近细胞膜时,单个SNARE分子就会像拉链的两边一样彼此相对排列,并以这种方式将细胞膜拉得更近。囊泡在这种状态下等待着发令枪,等待它们的融合——可以说是在起跑线上。
神经生物学家在Göttingen上的发现证明了Munc13, CAPS和SNARE蛋白紧密排列囊泡和细胞膜在突触中,远在发出融合信号之前。这是唯一的方法,可以保证信息在突触的快速和可控的传输,感谢它,我们可以对来自我们的环境的信息作出特定的反应。很久以前就很清楚了突触必须非常快才能完成所有复杂的大脑功能。我们的研究第一次展示了这是如何在分子水平和突触囊泡水平上管理的,”Brose说。因为几乎所有参与这一过程的蛋白质成分也在神经和精神疾病中发挥作用,Göttingen-based科学家相信他们的发现将很快有益于医学研究。bob88体育平台登录