阻断血管生成的药物可能为结核病提供新的治疗方法
人体对结核病感染的反应是将细菌罪犯锁定在称为肉芽肿的微小免疫细胞簇中,这是结核病的一个标志。这种遏制策略一开始成功了,但最终细菌设法冲出这些细胞间的监狱,扩散到全身。
现在,研究人员已经证明,这种逃脱是由新的帮助血管这条通往肉芽肿的隧道,为里面的细菌提供新鲜的氧气和一条出路。他们测试了fda批准的阻断这一过程(称为血管生成)的药物,发现它们可以有效地减少细菌的数量,限制它们在肉芽肿外的传播,并增加受感染实验动物的存活率。
该研究结果发表在11月24日的《纽约时报》网站上自然,提出了一种新的治疗方法,可能针对人体对结核病的反应,而不是直接针对细菌。
杜克大学医学院分子遗传学和微生物学助理教授David M. Tobin博士说:“血管生成是由肉芽肿引发的宿主反应,细菌利用它生长并维持充足的氧气供应,最终扩散。”
托宾说:“我们认为通常用于癌症的抗血管生成剂可能是治疗结核病的全新途径。”“这种以宿主为导向的治疗方法在目前抗生素治疗方案无效的耐多药疾病病例中尤其有效。”
结核病是全世界传染病死亡的主要原因,仅次于艾滋病毒/艾滋病。世界卫生组织最近的一份报告发现,仅在2013年,就有900万人患上结核病,150万人死于这种疾病。虽然有几种药物疗法被批准用于治疗这种疾病,但这些治疗方法可能很耗时,有毒,而且对大多数耐药菌株无效。
研究人员利用各种动物模型,包括在许多宠物店和家庭水族馆中发现的斑马鱼,来寻求结核病的替代疗法。这种小鱼可能会被其天然病原体海洋分枝杆菌感染,这是导致人类结核病的结核分枝杆菌的近亲。
很明显,这种鱼没有肺,但它们会长出肉芽肿,在结构上与人类结核病患者的肉芽肿相似。
托宾曾帮助开发斑马鱼作为结核病的模型,他决定使用该系统来研究与肉芽肿相关的血管。他和他的博士后Stefan H. Oehlers博士想要确定这些新血管是对宿主有益还是对细菌有益。
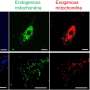
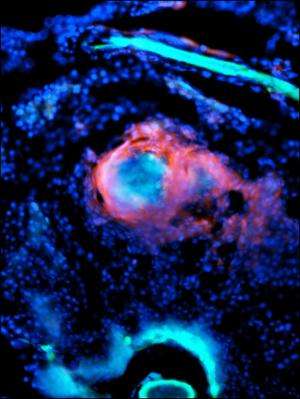
由于斑马鱼在成年后条纹出现之前是透明的,Oehlers可以用不同颜色的荧光标签标记细菌、免疫细胞和脉管系统,然后随着时间的推移跟踪结核病感染。当他用亮蓝色的海洋分枝杆菌感染斑马鱼时,他看到了亮红色免疫细胞迅速包围细菌形成紧密组织的肉芽肿。几天内,可以看到亮绿色的血管在这些小细胞球内部和周围发芽。他们发现新的血管是功能正常的血管红细胞和正常血管一样。
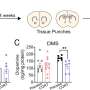
研究人员想知道如果阻止新血管形成会发生什么。如果它们对宿主很重要,那么阻断这一过程只会使感染更严重。但如果它们的目的是帮助细菌生长和传播,那么阻断这一过程可以帮助控制感染。为了区分这两种可能性,研究人员在斑马鱼的水中加入了抗血管生成药物semaxinib和pazopanib,这两种药物已经被用于治疗癌症。
他们发现,这些药物抑制了新血管的生长,减少了细菌的数量,并限制了结核在肉芽肿外的传播。重要的是,用流行的抗癌药物pazopanib治疗结核病斑马鱼的存活率提高了两倍。抗血管生成药物也提高了一线结核病治疗药物利福平的有效性。
“我们认为切断血管生长会导致结核病细菌有效地扼杀病原体,使其更容易成为免疫系统的目标,”斯特凡·厄勒斯说。“现在我们想证明,靶向宿主血管在其他临床前结核病模型中是有效的。”
更多信息:Stefan H. Oehlers, Mark R. Cronan, Ninecia R. Scott, Monica I. Thomas, Kazuhide S. Okuda, Eric M. Walton, Rebecca W. Beerman, Philip S. Crosier和David M. Tobin,“宿主血管生成信号的截获限制了分枝杆菌的生长”。自然, Advance Online, 2014年11月24日。DOI: 10.1038 / nature13967