FDA批准扩大主动脉置换阀在阀
(每日健康)- - -美国食品和药物管理局周二表示,使用CoreValve valve-in-valve“主动脉瓣替换已经扩大到包括人们在极端的传统开胸手术的严重并发症的风险。
CoreValve系统是专为那些之前主动脉瓣置换术,现在需要第二个,FDA在一个新闻发布会上说。有些人的阀门磨损有心脏手术替换原来的阀有一个由动物组织。当第二个阀CoreValve规定产品可能需要更换。
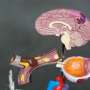
CoreValve阀是由从猪的心脏组织。它连着一个支持性的金属框架的镍钛合金制成,FDA说。通过导管插入一条腿插入动脉,或通过一个小切口在肋骨之间。这消除了传统的必要性开胸手术。
阀门是评估在临床试验中涉及143人。人收到阀门的存活率是95.8%后30天内,89.3%的人在六个月后,该机构说。
更换阀的主要风险是死亡,中风、肾损伤、心脏病、出血和永久起搏器的必要性。产品不应该被感染的人,一个机械主动脉瓣,在人不能服用稀释血液的药物,和那些有敏感钛、镍或成像对比流体。
设备是由美敦力公司,总部设在明尼阿波利斯。
更多信息:FDA更多有关这个批准。
版权©2015每日健康。保留所有权利。