保持膜质膜
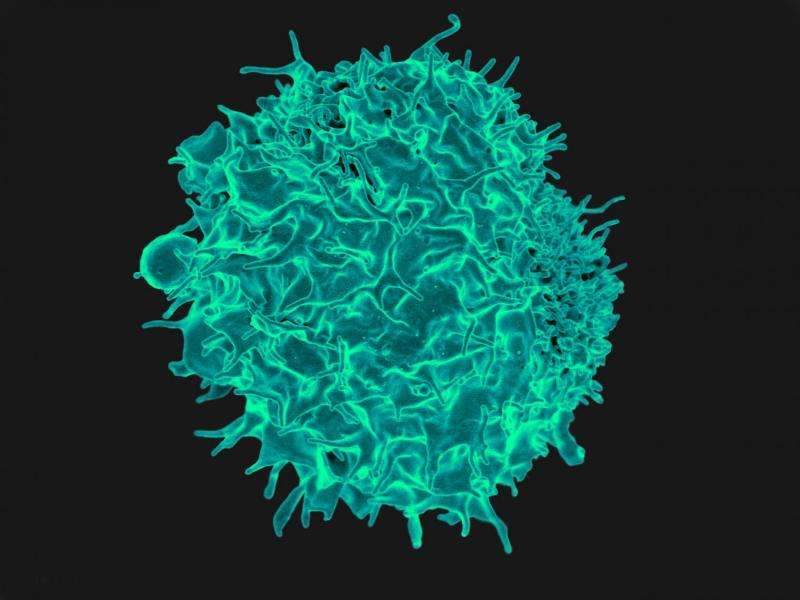
调节性T细胞(Treg细胞)是制衡系统的一部分,它可以防止免疫反应过度而导致自身免疫疾病。尽管它们对形成免疫反应和保持自我耐受性至关重要,但它们如何保持其免疫抑制能力仍不清楚。现在,拉霍亚过敏与免疫学研究所(La Jolla Institute for Allergy and Immunology)的研究人员首次发现了一种维持Treg细胞稳定性和功能的分子途径。
他们的调查结果,在6月16日发表的问题免疫,确定蛋白质降解途径,这是一个氧气传感器在许多细胞类型中,作为Treg的关键调节器细胞的函数。当Treg细胞失活后,它们不仅失去了免疫抑制功能,而且开始自身产生炎症信号,导致全身出现大量炎症。
“由于Treg细胞的抑制作用,人们一直试图在人类自身免疫疾病或移植中使用这些细胞进行治疗,”刘蔡刘博士教授,博士学位讲授了当前的研究。“我们的结果表明,这些细胞可能不稳定,并且在某些条件下,可能甚至转换为炎症细胞。他希望进一步研究可以识别对基于免疫癌症治疗的新方法,或揭示炎症性疾病的新药物靶标。
Liu和他的团队开始对Treg细胞的不稳定性现象感兴趣,因为早期的研究暗示了Treg细胞的变形能力,但没有确定特定的分子机制来确保它们的功能稳定(或缺乏功能)。Treg细胞集中在低氧区域,通常出现在肿块中心或炎症组织中。博士后研究员、第一作者Jeeho Lee博士说。
缺氧诱导因子1α (HIF-1α)氧传感器它控制着低氧条件下葡萄糖代谢的各种基因的表达,是von Hippel-Lindau (VHL)酶的底物中记录最充分的。在正常的氧气条件下,VHL标志着蛋白质会被细胞的蛋白质处理机制破坏。然而,当氧气缺乏时,HIF-1α开始积累并开启一系列基因的表达,这些基因有助于促进和增加氧气输送到缺氧区域。
早期的研究表明HIF-1α在调节免疫系统- 结果冲突。“我们希望通过直接解决Treg Cells中的问题来探讨HIF-1α的作用,”李说。
当LJI研究人员通过基因工程使Treg细胞缺乏VHL时,这些细胞内HIF-1α的数量如预期的那样急剧增加。但是,更重要的是,Treg细胞变得高度激活,并开始产生大量的炎症细胞因子,这是免疫系统细胞分泌的化学信使,用于相互交流。
“许多组织和器官的结果严重和广泛炎症,”李观察。另外,它转移了细胞'葡萄糖新陈代谢从好氧到厌氧。这些变化导致产生有害代谢物,即甚至进一步增加炎症。
“我们的研究暗示了不同组织中的氧水平的变化可以通过Treg细胞感测,并且该方法对维持免疫系统的激活和抑制之间的正确平衡至关重要,”刘说。
进一步探索






用户评论