突变的p53肿瘤抑制蛋白使用表观遗传学来驱动侵袭性癌症生长
宾夕法尼亚大学佩雷尔曼医学院的一项新研究表明,在不改变DNA序列(表观遗传学)的情况下,癌症的侵袭性生长和基因活性的改变与p53蛋白突变有关。这个国际研究小组描述了他们的研究结果和对难以治疗的癌症的影响自然在线先于印刷。这项研究由Daniel S. Och大学细胞与发育生物学、遗传学和生物学系教授Shelley Berger博士领导,以及第一作者Berger实验室的博士生Zhu Jiajun,以及多伦多大学的同事。
TP53是所有人类癌症中最常发生突变的基因。它编码了制造一种叫做肿瘤蛋白p53的蛋白质的指令,这种蛋白质通常通过调节细胞分裂周期来抑制肿瘤。的p53蛋白这是通过防止细胞生长和分裂过快或不受控制的方式来实现的。当DNA受到损伤时,p53会引发一系列保护反应来修复细胞,如果损伤太严重,则会导致细胞自杀。TP53基因的突变会破坏这种正常功能,并允许DNA受损的细胞继续分裂,从而导致癌症。
在大多数情况下,突变的p53蛋白是由一个DNA构建单元的单一突变引起的,导致p53蛋白中的单一氨基酸取代。除了失去正常的p53抑制肿瘤的功能外,p53的替代形式也获得了以更积极的方式促进癌症发展的功能。
为了更好地理解突变型p53“功能获得”(GOF)是如何工作的,宾夕法尼亚大学的研究小组研究了来自不同类型p53 GOF氨基酸取代的患者肿瘤的癌细胞系,以观察这些突变型p53在癌症基因组中的实际结合位置。
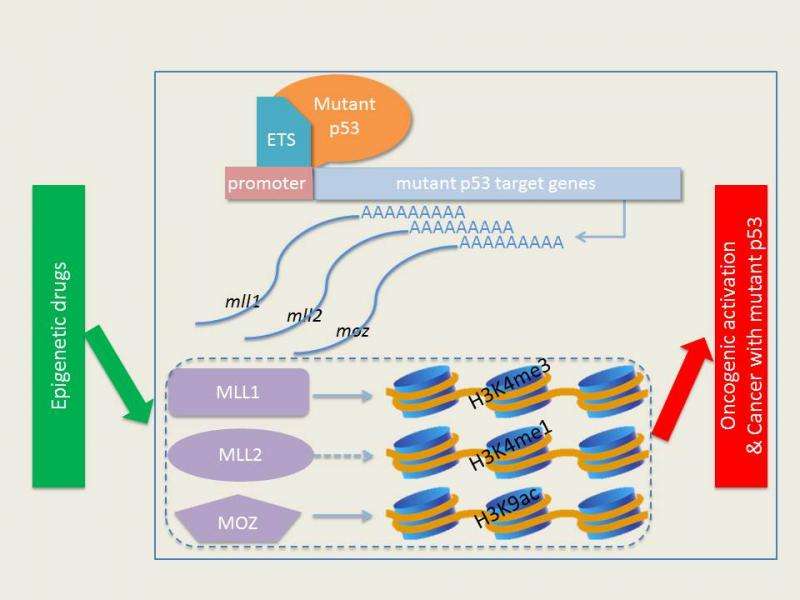
伯杰说:“我们惊讶地发现,突变的p53结合并激活了一组包含表观遗传特征的基因,特别是那些与组蛋白甲基化和组蛋白乙酰化有关的基因。”特别是,GOF p53突变蛋白直接靶向编码关键表观遗传酶的基因,包括MLL1、MLL2和MOZ。
为了支持他们的观察,研究小组使用了癌症基因组图谱(TCGA),这是一个公开的国家癌症研究所多种类型肿瘤患者遗传特征的数据库。他们对TCGA数据的分析显示,与正常p53蛋白或不含p53蛋白的肿瘤相比,GOF p53肿瘤中表观遗传调控MLL1、MLL2和MOZ基因的表达增加。
基因表达由染色质上的化学修饰(包括甲基化和乙酰化)调控-组蛋白与DNA紧密相关。组蛋白上的某些化学基团允许DNA打开,而其他化学基团则使染色质收紧。这些基团改变了DNA在基因组某些区域的致密程度,进而影响哪些基因可被制成RNA(这一过程称为转录),并最终成为蛋白质,这是许多过程的第一步,包括细胞增殖。
通常情况下,作为一种表观遗传酶,MLL1在组蛋白上放置一个甲基,在一个促进转录和有利于细胞生长的地方。例如,他们发现突变的p53蛋白进入MLL1通路,导致全基因组组蛋白甲基化变化,因此允许不受控制的细胞复制。
改变的表观遗传途径涉及癌症的各个方面,考虑到表观遗传相关蛋白质对全基因组转录程序的调节,这可能是解释一些不受控制的细胞复制的合理机制。这一发现为GOF突变p53直接调控关键表观遗传因子提供了第一个证据。
为此,最重要的是,研究小组发现,通过敲除MLL1基因,癌细胞增殖显著下降,这与敲除GOF p53突变基因导致细胞增殖下降的结果相同。
伯杰说:“现在我们已经确定,我们可以通过基因抑制MLL1来抑制细胞增殖,特别是在p53突变的肿瘤中,我们还测试了是否可以从药理学上抑制MLL1。”“我们发现这些细胞系非常容易受到影响。”通过使用靶向MLL1活性的药物,研究小组发现p53突变细胞的生长速率也有类似的抑制作用。
伯杰说:“我们的研究揭示了一种新的表观遗传机制,这种机制潜藏在功能获得性p53突变的肿瘤进展中。”“这些发现表明,这些类型的癌细胞在这些特定的改变中茁壮成长。功能获得性p53肿瘤细胞当这些调控因子被击倒或在药物上被抑制时,就无法肆意复制。”
除了MLL1、MLL2和MOZ之外,该研究还揭示了突变p53靶向许多其他编码表观遗传调控因子的基因。由此,研究人员的目标是开发组合表观遗传疗法,以治疗由GOF p53突变驱动的个体癌症。这些类型的癌症包括但不限于胰腺癌、乳腺癌、脑癌、食道癌、头颈癌——所有严重的癌症都以无法治疗和晚期诊断为特征。