ALS蛋白质动力学强调self-association之间微妙的平衡和聚合
ALS-related蛋白TDP-43病理的第一步聚合作为其正常功能的一部分,根据一项新的研究发表在开放获取期刊公共科学图书馆生物学2016年1月6日。林建兴研究Liangzhong Lim,歌曲,和他的同事们在新加坡国立大学,支持新兴的想法,蛋白质聚集在神经系统疾病可能是一个夸张的正常功能聚合的蛋白质。
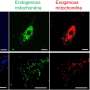
胞质骨料的正常TDP-43中发现几乎所有形式的肌萎缩性脊髓侧索硬化症(肌萎缩性侧索硬化症)致命的神经退行性疾病影响运动神经元额颞叶痴呆的,以及在许多情况下(FTD)。TDP-43聚合已经观察到在ALS和FTD ~ 45% ~ 97%的病人。它也涉及一系列其他神经退行性疾病的患者,包括最近,阿尔茨海默氏症。
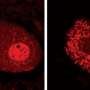
研究蛋白质的生物物理属性,包括聚合动力学,阻碍了其强大的聚集倾向,作者最近的问题克服了通过减少盐浓度在体外。在这里,他们使用各种光谱和微观技术详细描述TDP-43 c端prion-like域的结构,以及蛋白质域的形式通过交互动态寡聚物单独或与核酸相互作用的蛋白质分子。而突变TDP-43 ALS的罕见的原因,这个prion-like域主机TDP-43大部分ALS-causing突变。作者表明,这些突变增加装配和拆卸的寡聚物,减少倾斜向聚合成淀粉样原纤维的平衡。作者还发现,一个地区的蛋白质曾被发现与细胞膜毒性促进其协会是必要的,这可能会增加聚合的倾向。
这些结果进一步凸显了微妙的平衡之间的正常功能和病理aggregation-prone TDP-43等蛋白质,并可能有助于解释如何聚集non-mutated蛋白质形式的肌萎缩性侧索硬化症。作者还建议减少TDP-43 membrane-association潜力”可能代表一个有前途的治疗策略来治疗神经退行性疾病。”
更多信息:陆Lim L,魏Y, Y,歌J (2016) ALS-Causing突变明显扰乱自组装与核酸相互作用的内在无序Prion-Like TDP-43的领域。公共科学图书馆杂志14 (1):e1002338。DOI: 10.1371 / journal.pbio.1002338