研究人员努力阻止关键的Alzheimer酶的有害行为
酶很少有一份工作。因此,试图关闭导致阿尔茨海默病的标志的酶通常意味着副作用,因为这些疗法可防止酶进行许多其他功能。出现2月25日的一项研究细胞报告提出了一种新的治疗策略:阻断最有害的行为酶,同时允许它正常工作。现在需要在临床前试验中进一步开发和测试这种潜在方法。
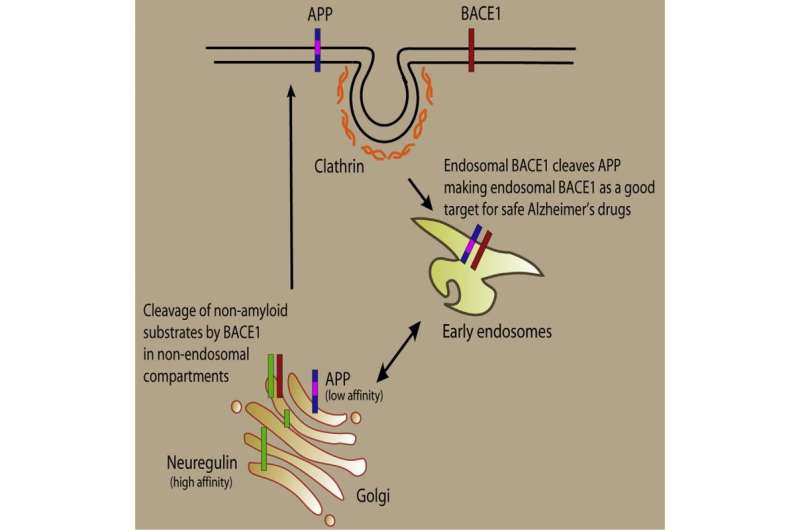
在阿尔茨海默病患者(Ad)的患者中,分裂淀粉样蛋白前体蛋白质,以及所得片段-β-淀粉样肽,或形成斑块的β肽 - 聚集体。Aβ肽是通过称为β-和γ分泌酶的两种酶的作用产生的。抑制这些酶中的任一个将阻断有毒Aβ肽的产生;然而,试图抑制γ-分泌酶导致临床试验中的问题,因为酶还粘土超过20种其他蛋白质对于正常生理学很重要。β-分泌酶现在被认为是AD的替代治疗靶标,并且已经开发了各种各样的抑制剂;然而,β-分泌酶也裂开了几种具有正常功能的其他蛋白质。
在瑞士苏黎世大学的最新研究中,他的同事发现,与非淀粉样蛋白不同,阿尔茨海默氏蛋白相关的淀粉样蛋白不同前体蛋白质通过β-分泌酶在细胞内的膜结束隔室中切割,称为底皮物。利用这种隔间化,该团队开发了一种特异性地阻断的内靶向β-分泌酶抑制剂淀粉样蛋白前体蛋白但不是非淀粉样蛋白。这是第一次实现了这种特异性,因此提供了一种治疗广告的潜在有希望的方式,而不会导致主要副作用。
“目前的β-分泌酶抑制剂抑制阿尔茨海默氏症的疾病过程和生理学相关的过程,这将是一个主要问题,类似于诊所失败的γ分泌酶抑制剂;但是,通过我们的策略,我们现在可以专门抑制阿尔茨海默氏症的过程从而避免了任何副作用,“拉墨特兰说。他和他的团队计划进一步发展这种抑制剂并测试临床试验。
进一步探索












用户评论