研究者确定当帕金森蛋白质成为大脑细胞毒性
研究人员使用一种非侵入性的方法观察的过程导致帕金森病发生在纳米尺度上,并确定了在大脑中蛋白质的过程变得有毒,最终导致脑细胞的死亡。
结果表明,相同的蛋白可以引起,或防止毒性作用导致脑细胞的死亡,根据具体的结构形式,这毒性抓住当有一个水平的失衡在细胞中蛋白质的天然的形式。工作可以帮助解开如何以及为什么人们开发帕金森氏症,和援助在寻找潜在的治疗方法。这项研究发表在《华尔街日报》美国国家科学院院刊》上。
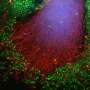
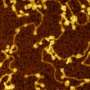
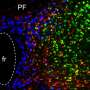
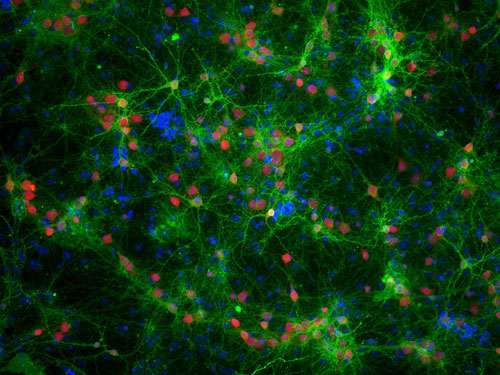
使用超分辨率显微镜,剑桥大学的研究人员可以观察到不同类型的α-突触核蛋白的行为,一种蛋白质与帕金森病密切相关,为了找到它如何影响神经元,什么时候变成有毒的。
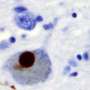
帕金森病是引起的神经退行性疾病之一,当天然蛋白质折叠成错误的形状和与其他蛋白质结合在一起,最终形成薄丝状结构称为淀粉样原纤维。这些淀粉样蛋白沉积聚合的α-突触核蛋白,也称为路易小体,是帕金森病的标志。
帕金森病是世界第二大常见的神经退行性疾病(在阿尔茨海默病)。近130000人在英国,和七百万多名在世界范围内,有疾病。症状包括肌肉震颤、刚度和行走困难。痴呆是后期的常见疾病。
”还没有清楚的是一旦α-突触核蛋白原纤维形成了他们是否仍然对细胞有毒,”博士说多萝西娅Pinotsi剑桥大学化学工程系和生物技术,论文的第一作者。
Pinotsi和她的同事们从剑桥大学化学工程与生物技术和化学部门,并由Gabriele卡明斯基Schierle博士用光学的超分辨率技术观察生活的神经元,并且不会对人体造成任何伤害。”现在我们可以看看如何与神经退行性条件下随着时间的增长,相关的蛋白质,这些蛋白质在一起并传递给相邻的细胞,“Pinotsi说。
研究人员使用不同形式的α-突触核蛋白和观察他们的行为在小鼠的神经元。他们可以联系他们看到的,是存在的毒性。
他们发现,当α-突触核蛋白原纤维添加到神经元,它们与α-突触核蛋白蛋白已经在细胞中,而没有毒性作用。
“这是认为淀粉样原纤维,攻击健康细胞中蛋白质对细胞具有毒性,“Pinotsi说。“但是当我们添加了一个不同的,可溶性形式的α-突触核蛋白,它不与蛋白质相互作用已经出现在神经元和有趣的是,这是我们看到毒性和细胞开始死亡。所以,可溶性蛋白质时补充道,它创造了这个毒性作用。损害似乎做过可见纤维甚至形成。”
然后研究人员观察到,通过添加可溶性形式的α-突触核蛋白与淀粉样原纤维,前者的毒性作用可能被克服。看来,这个淀粉样纤维像磁铁的可溶性蛋白质和可溶性蛋白质池清理战场的时候,屏蔽对相关的毒性作用。
“这些发现改变我们观察疾病的方式,因为神经元损伤可能发生时,仅仅是额外的可溶性蛋白在细胞——这是多余的蛋白质似乎引起毒性作用,导致的死亡大脑细胞,”Pinotsi说。额外的可溶性蛋白可能是由于遗传因素或老化,尽管有证据表明,它也可能是由于头部创伤。
研究表明有多么重要完全理解背后的工作流程神经退行性疾病,所以正确的步骤过程可以有针对性。“这些光学超分辨率技术,我们可以真正看到我们看不到细节之前,我们也许能够抵消这毒性作用在早期阶段,“Pinotsi说。
进一步探索