靶向两个血管生成途径可以改善胶质母细胞瘤治疗的结果
马萨诸塞州总医院(MGH)研究团队的两篇相关论文表明,同时靶向多种血管生成途径可以帮助克服破坏性脑肿瘤胶质母细胞瘤不可避免地产生的抗血管生成治疗的耐药性。出现在PNAS早期版本,报告描述了在动物模型中抑制血管内皮生长因子(VEGF)和血管发成素-2(Ang-2)的两种不同的方法在更大程度上仅仅比单独的抗VEGF疗法归一化肿瘤血管将肿瘤浸润的免疫细胞从促肿瘤转移到抗肿瘤状态的作用。
这些论文提供了一种可能的解决方案胶质母细胞瘤逃离抗VEGF治疗,通过激活替代生长因子途径介导的,“MGH放射肿瘤部门肿瘤生物学系的钢材实验室主任,博士学位博士说,两篇论文的共同作者“在我们的背靠背篇论文中,我们不仅提供了双重的原则数据治疗策略可以减缓胶质母细胞瘤的生长,提高存活率,但也揭示了这些好处的潜在机制。”
胶质母细胞瘤是大脑中最常见的恶性肿瘤,其特点是血液供应高度异常、渗漏和低效,由血管生成因子如VEGF的过表达引起。这些血管异常导致肿瘤周围肿胀,肿瘤内血液灌注不足,使肿瘤变得更有侵略性,对化疗和放疗产生抗药性。虽然抗vegf治疗已经成为胶质母细胞瘤术后标准治疗的一部分,但其有益作用是暂时的,并不能延长患者的生存期。
这些MGH团队成员的先前研究表明,接受抗VEGF治疗的胶质母细胞瘤患者也有血液水平的瞬时下降。随着肿瘤进展恢复反弹的那种因素的水平,表明Ang-2活性可能有助于抗VEGF治疗抵抗力。研究人员还发现,类似于VEGF,Ang-2的胶质细胞组织表达。为了捕获不同胶质细胞瘤类型的多样性,研究人员设计了两种测试抑制途径是否可以克服治疗抵抗的方法。
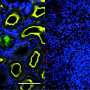
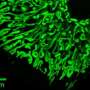
一种方法将实验性口服抗vegf药物cediranib与ang -2中和抗体在两种胶质母细胞瘤小鼠模型中结合使用,发现与单独cediranib治疗相比,双重治疗改善了血管正常化并延长了生存期。双重治疗还吸引了肿瘤相关巨噬细胞(TAMs)到肿瘤,并增加了这些免疫细胞的抗肿瘤形式的比例。重要的是,阻断TAMs向肿瘤的迁移减少了双重治疗的好处。
第二项研究使用了一种同时针对VEGF和Ang-2的抗体,表明双重治疗改善了血管异常小鼠模型的肿瘤血管结构。在这个肿瘤模型和另一个没有血管异常的模型中,TAMs被重编程为抗肿瘤状态,这表明血管正常化不是唯一的获益机制。事实上,双重治疗通过将TAMs的群体转移到抗肿瘤的形式来促进抗肿瘤免疫,这与第一项研究一致,但与周围血管是否异常无关。
“我们的研究表明,VEGF和Ang-2的双重靶向可以克服目前可用的胶质母细胞瘤疗法的一些缺点,”Jain说,哈佛大学医学院肿瘤生物学肿瘤生物学教授。“目前可用于这种双重针对策略的临床可访问的代理商,我们发现双重治疗也可以改善抗议性肿瘤免疫应答,无论其对血管的影响,尤其是新免疫治疗的快速发展。这些结果开放了新的新组合研究的新途径,以获得更耐用的结果免受这种破坏性疾病。“
进一步探索
Ang-2 / Vegf双特异性抗体重新编程巨噬细胞和常规小胶质细胞对抗肿瘤表型并延长胶质母细胞瘤生存,PNAS,www.pnas.org/cgi/doi/10.1073/pnas.1525360113.







用户评论