用于细胞标记和邻近依赖生物素化的工程单体链霉亲和素
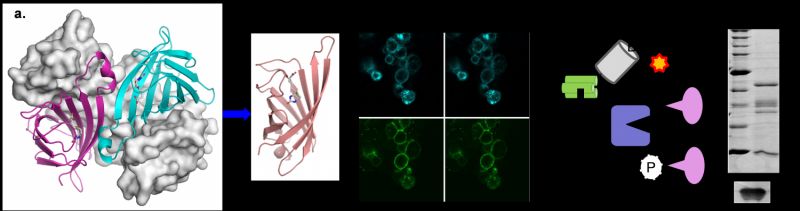
来自纽约州阿姆赫斯特布法罗大学的一组研究人员成功地设计了一种新的链霉亲和素变体,它能形成稳定的单体,并能够检测出单价生物素。链霉亲和素广泛用于生物素化配体的检测,但可能导致靶标交联,干扰分子水平的观察。工程链霉亲和素单体(mSA)由于只有一个生物素结合位点,所以与生物素化的靶标没有交联。作为一种结构单体,mSA还可以与另一种蛋白质基因融合形成生物素结合标记。生物素化配体与融合的mSA结构域的结合在各种生物化学和细胞生物学研究中是有用的。mSA设计的优化及其在标记和蛋白质-蛋白质相互作用研究中的潜在应用将在即将出版的2016年期刊中进行描述技术.
“原生链亲和素与生物素的相互作用具有局限性,这源于链亲和素的专性四聚体结构。布法罗大学(University at Buffalo)的Sheldon Park博士说:“一种与生物素结合的小的单结构域蛋白,如mSA,通过允许单价生物素检测和基因融合的产生,扩展了链亲和素-生物素系统的效用。”
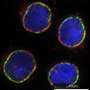
链霉亲和素及其同源物都形成寡聚体,这使得它们很难用作基因融合物。该团队此前报道了一种稳定的单体蛋白的工程,它可以结合具有低纳米亲和力的生物素,并证明了该分子可以与GFP融合,从而创建一个双功能分子。在这项研究中,该小组优化了设计,并演示了工程分子如何在生物技术中使用。mSA结合特性的显著改进包括生物素结合复合物的稳定,以实现生物素化靶标的一致标记。例如,使用与荧光团结合的mSA,细胞表面的生物素化受体可以在1小时内稳定标记,而且几乎没有信号损失,这在荧光显微镜研究中应该是有用的。
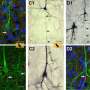
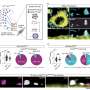
与寡聚链霉亲和素不同,mSA可以很容易地与感兴趣的蛋白(POI)融合,构建生物素结合的重组标签。目前的研究探索了mSA融合在邻近依赖生物素化中的应用,这一技术已被证明在蛋白质组学研究中很有用。近缘依赖生物素化利用酶或化学方法对与POI相互作用的分子进行选择性生物素化,这样就可以使用固定化链霉亲和素对它们进行亲和纯化。作者证明,mSA标记可用于招募活性生物素物种,并实现直接或间接相互作用的分子的特定生物素化。由于只需要与mSA共定位才能工作,所以不需要直接与mSA融合。相反,mSA可以通过一系列的非共价相互作用(例如,与抗体)被招募到POI,以靶向相互作用的分子进行生物素化。该设计提供了高水平的模块化,并适用于仅短暂相互作用的分子,如酶及其底物。
来自UB的团队正在努力进一步降低生物素的解离率,以便进一步优化标记效率。为此,在实验室测试之前,mSA (PDB 4JNJ)的晶体结构被用来模拟各种突变的影响。mSA生化特性的改善及其显著的小体积(约为链亲和素的25%)通过利用现有的基础设施和链亲和素-生物素系统的普遍存在来研究新的相互作用,为生物技术创造了新的机会。
进一步探索