科学家揭示心内膜肝脏血管的起源
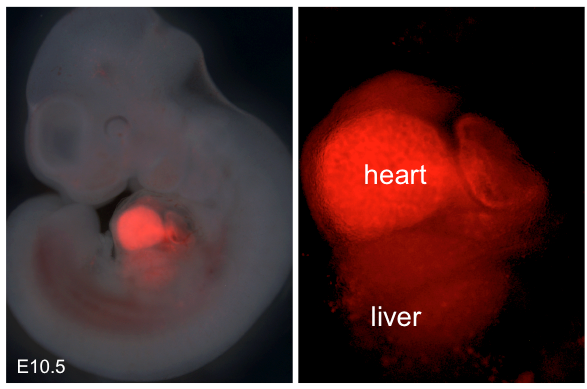
3月29日,自然遗传学发表了一篇研究文章题为“遗传谱系追踪识别心内膜肝脏血管的起源,”周本教授的实验室营养科学研究所(INS),中科院上海生命科学研究院。
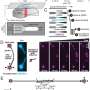
利用遗传谱系追踪和修复基因敲除技术,研究人员发现,的一部分肝血管来源于发展中心脏心内膜。在这个过程中,心脏内的VEGF / VEGFR2信号肝脏血管和器官形成中起着重要的作用。
血船只是必不可少的肝功能在体内平衡和损伤后再生。在胚胎发育过程中,血管形成被动渠道提供氧气和营养。研究者建立有益的发展领域,促进肝脏器官发生前出现循环。确定肝血管形成的发展计划提供了基础的设计策略来刺激血管生长在肝脏再生。
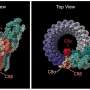
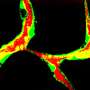
利用基因的老鼠的工具,特别是标签心内膜,研究者进行了谱系追踪实验,发现心内膜细胞在早期胚胎的心脏可以迁移,形成原始肝脏周围血管丛芽。
肝脏与发展,血管丛,在肝脏器官形成中扮演重要角色,分化成中央静脉,正弦信号内皮细胞静脉和动脉,门户。有趣的是,这些endocardium-derived内皮细胞也可能形成淋巴内皮细胞的一部分。值得注意的是,这些endocardium-derived肝脏血管反应损伤期间和增殖形成新的血管肝再生后部分肝切除术。
通过区间的血统追踪技术,研究人员发现,endocardium-derived肝脏血管来自静脉窦心内膜,也是冠状血管的起源。这是第一次研究证明存在一个共同起源肝脏血管和冠状动脉vessels-sinus venosus。
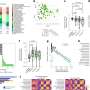
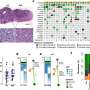
VEGF / VEGFR信号通路对于血管生成是至关重要的,在扩散中扮演重要角色,迁移、血管内皮细胞的生存和渗透。VEGFR的家庭有三个成员:VEGFR1 (Flt1) VEGFR2 (KDR / Flk1),和VEGFR3 (Flt4)。VEGFR2, VEGF通过绑定激活,主要分布在血管内皮细胞。在这项研究中,研究人员发现高表达VEGF在肝细胞肝癌萌芽发展,和高表达VEGFR2心内膜。
这个表达式地图表明可能存在肝细胞之间的相互作用及心内膜通过VEGF / VEGFR2信号通路。组织删除VEGFR2心内膜导致显著降低的endocardium-derived在肝脏、血管和发育异常的肝脏只有四分之一的大小比较的控制。因此,VEGF / VEGFR2信号通路可能影响肝脏器官发生通过调节endocardium-derived肝脏血管的形成。
更多信息:回族Zhang et al。遗传谱系追踪识别心内膜肝脏血管的起源,自然遗传学(2016)。DOI: 10.1038 / ng.3536