两种疫苗的埃博拉病毒疗法显示承诺在早期的临床试验
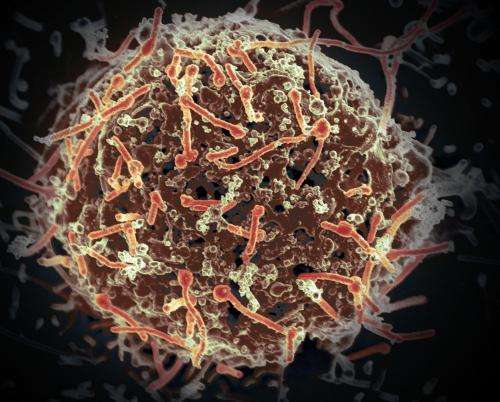
一个使用两个埃博拉病毒候选疫苗免疫疗法是安全的,同时和诱导免疫反应在健康成人志愿者1期临床试验。研究的结果在4月19日的描述美国医学协会杂志》上。国家过敏症和传染病研究所(NIAID),国立卫生研究院(NIH)的一部分,支持两种临床实验疫苗的开发和测试:Ad26。ZEBOV,由Crucell荷兰帐面价值MVA-BN-Filo,由巴伐利亚的北欧。
Ad26。ZEBOV疫苗使用腺病毒载体或载体,传递遗传物质从扎伊尔ebolavirus(负责2014 - 2015年爆发的病毒在西非),促使人体产生免疫反应。MVA-BN-Filo疫苗工作同样,使用修改后的牛痘病毒安卡拉向量(MVA)提供相同的埃博拉病毒遗传物质,加上苏丹ebolavirus的衬垫、大森林ebolavirus和相关的马尔堡病毒。腺病毒,轻微的呼吸系统疾病的常见原因在人类,和MVA,牛痘病毒的弱化版(痘病毒),已经成功测试了实验性疫苗平台。
审判是在英国牛津大学的科学家从2014年12月到2015年10月,招收了87名健康成年人年龄从18岁到50年。调查人员划分为72个参与者18随机分成四组。在第一天,每组三个收到了盐水安慰剂,另15 Ad26接受注射。ZEBOV或MVA-BN-Filo。参与者就收到了升压剂与其他候选疫苗或第二个安慰剂28 56天后。五分之一组15参与者进入一个非随机组收到了Ad26。ZEBOV疫苗在第一天。这一组,12个参与者收到MVA-BN-Filo试验性疫苗14天后;三个参与者并没有得到提高。
研究人员发现,Ad26。ZEBOV MVA-BN-Filo试验性疫苗是安全的,没有造成严重的与疫苗相关的不良反应。所有参与者收到了Ad26。ZEBOV疫苗第一(总理)其次是MVA-BN-Filo作为助推器疫苗开发和维护埃博拉病毒抗体免疫后八个月,大约80%的同一组也保持诱发t细胞,帮助身体抵御感染。这种持久的保护可能是重要在断断续续的埃博拉暴发的地区,为社区提供基线保护。的疫苗各临床试验方案正在进一步测试在世界范围内,包括NIAID-supported第一阶段试验Crucell荷兰帐面价值马里兰州罗克维尔市,这正在发生。