老鼠研究心脏再生端粒长度的链接
西班牙国家心血管研究中心的研究人员已经发现,心肌细胞染色体的末端迅速侵蚀出生后,限制了细胞的增殖能力和替换受损的心脏组织。研究中,“产后通过p21激活端粒功能障碍诱发心肌细胞细胞循环逮捕,“将会刊登在5月30日,2016年《细胞生物学》杂志上表明,潜在的新干预措施以提高心脏的心脏病发作后自我修复的能力。
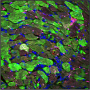
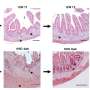
新生儿可以修复受伤的心肌,但在成人中,心脏病造成永久性伤害,常常导致心脏衰竭和死亡。新生鼠还可以再生受损的心脏组织。他们的心脏肌肉细胞、心肌细胞增殖和修复心脏在出生后第一周,但这再生能力丢失的老鼠长大和大多数心肌细胞退出吗细胞周期。
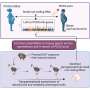
伊格纳西奥·弗洛雷斯和他的同事们在西班牙国家心血管研究中心为维基百科()在马德里怀疑细胞周期阻滞的原因可能包括端粒重复DNA序列,保护染色体的末端。例如,如果端粒变得太short-due telomere-extending端粒酶的损失enzyme-cells可以错误片段的染色体末端DNA受损,导致一个检查站逮捕的激活细胞周期。
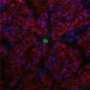
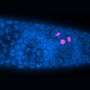
弗洛勒斯和他的同事因此检查染色体端粒的长度在新生鼠心肌细胞,发现端粒迅速侵蚀在出生后第一周。这侵蚀恰逢在端粒酶的表达减少,伴随着DNA损伤反应的激活和一个名为p21的细胞周期抑制剂。
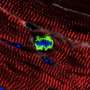
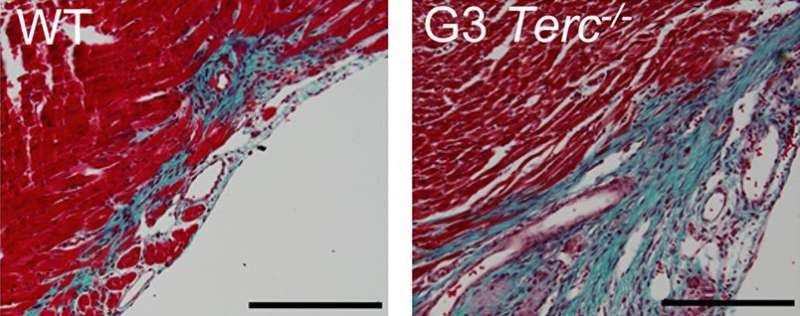
Telomerase-deficient小鼠有较短的端粒比野生动物,心肌细胞,研究人员发现,他们已经开始停止增殖出生后一天。当弗洛勒斯和他的同事们受伤的心刚老鼠,telomerase-deficient心肌细胞增殖或受伤的心肌再生失败。相比之下,野生型心肌细胞能够增殖和替换受损的组织。
他们还发现,敲出了细胞周期抑制剂p21延长心肌细胞的再生能力,允许1周p21-deficient老鼠来修复受损的心脏组织比刚刚更有效的野生动物。
维持心肌细胞端粒的长度可能因此提高成年细胞的再生能力,改善心脏组织后的恢复心攻击。“我们现在发展中端粒酶超表达小鼠模型,看看我们可以扩展再生窗口,“弗洛勒斯说。
更多信息:Aix et al . 2016。j .细胞杂志。DOI: 10.1083 / jcb.201510091