新一代mTOR抑制剂旨在对抗耐药肿瘤
霍华德休斯医学研究所的科学家们设计了一种潜在的癌症疗法,使用一种独特的策略来阻止mTOR,一种有助于推动许多肿瘤生长的分子。在动物实验中,这种药物可以减小对早期mTOR抑制剂有耐药性的肿瘤的大小。
这项研究于2016年5月18日发表在该杂志上自然这项研究由加州大学旧金山分校的HHMI研究员Kevan Shokat和纪念斯隆凯特琳癌症中心的Neal Rosen领导。
一些抗癌药物试图通过阻断mTOR来阻止肿瘤的生长,mTOR是生长调节网络的关键部分,在体内经常被破坏癌症细胞.这些药物中最古老的是雷帕霉素和相关分子rapalogs,在治疗几种癌症方面取得了一些成功,包括肾癌和乳腺癌。第二代mTOR抑制剂设计用于比rapalogs更有效地阻断mTOR信号,目前正在临床试验中进行评估。
不幸的是,经过几个月或几年的有效治疗,肿瘤可能会对rapalogs产生耐药性,而且很可能会对第二代mTOR抑制剂产生耐药性。这是分子靶向癌症治疗的一个常见问题,Shokat说。但如果研究人员了解了使癌细胞对药物产生抗药性的变化,他们就可以开发出新一代的治疗方法。
Shokat和他的同事们想要提前解决这个问题,他们开始考虑第三代mTOR抑制剂,而不是等待患者对最新疗法产生耐药性。为了预测耐药性是如何产生的,Rosen的团队将他们在实验室培养的乳腺癌细胞暴露在雷帕霉素或第二代mTOR抑制剂ADZ8055中三个月。大多数细胞都死亡了,但正如预期的那样,一些细胞找到了生存和繁殖的方法。
研究人员检查了这些耐药细胞,以确定使它们茁壮成长的特定变化,并推断接受药物治疗的患者可能会出现相同的变化。然后Rosen的团队在癌症患者的肿瘤基因数据库中寻找突变。
令他们惊讶的是,使实验室培养的细胞对ADZ8055产生抗性的突变甚至在治疗前就存在于一些患者的肿瘤中。肖卡特说:“这确实令人震惊,因为通常这些都是药物引起的突变。”这些变化出现在大约10%的肾细胞肿瘤(最常见的肾癌类型)中,增强了mTOR的活性,这意味着它们在有或没有ADZ8055的情况下都有助于肿瘤的生长。
Shokat说,携带这种突变的肿瘤患者永远不会对第二代mTOR抑制剂产生反应。“很快,这个项目就从‘病人将来会有这些突变,所以我们需要一种药物’变成了‘哇,病人已经有了这些突变,他们对我们临床使用的药物产生了耐药性。’”
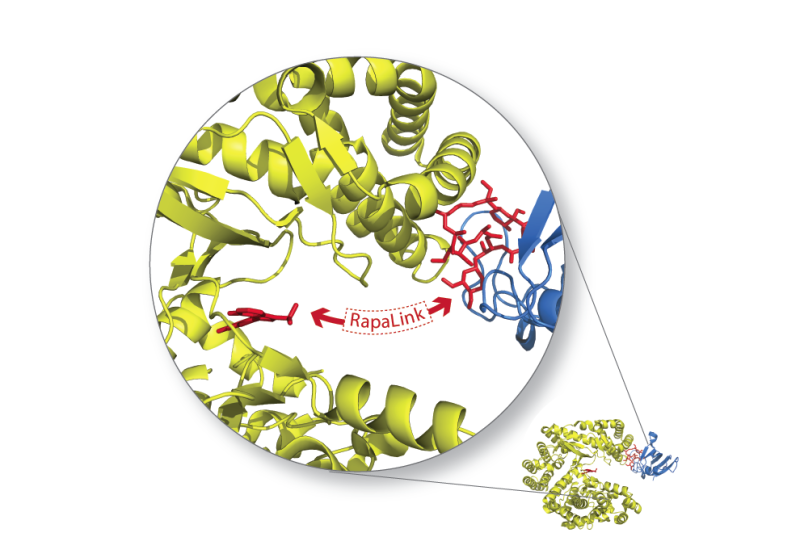
研究人员知道他们需要一种与之前的抑制剂工作方式不同的mTOR抑制剂。Shokat从免疫系统中获得了设计灵感。抗体善于与快速变化的靶标结合,这要归功于它们具有两个抗原结合尖端的y型结构。Shokat说,这两个结合位点使抗体对它们的目标具有很强的亲和力,他想通过创造一种在两个地方与mTOR结合的抑制剂来模仿这一策略。
他通过将第一代mTOR抑制剂(与分子的一部分结合)与第二代抑制剂(针对附近的一个单独口袋)连接起来实现了这一点。这种名为Rapalink的新型抑制剂可以在两个位点上吸附mTOR,并且比早期抑制剂的结合效果更好。
更重要的是,双管抑制剂可以抓住mTOR,即使它含有阻止更简单抑制剂结合的突变。这是因为两个mTOR结合位点都与药物完美匹配并不重要。Shokat解释说:一旦抑制剂的一侧锁定了目标,它的另一端就会被拴在自己的绑定袋附近,因此也可能锁定目标。
科学家们证明,Rapalink可以进入癌细胞并关闭mTOR,即使这些细胞对早期抑制剂有抗性。他们还测试了Rapalink的抑制能力肿瘤的增长动物实验他们发现,它可以减小对第一代或第二代mTOR抑制剂有耐药性的肿瘤的大小。肖卡特说:“它像魔法一样有效。
科学家们已经将Rapalink授权给了库拉肿瘤公司,后者将继续评估其作为癌症疗法的潜力。Shokat和Rosen是库拉肿瘤学的科学顾问。