T细胞分裂:一个潜在的目标为提高癌症免疫疗法
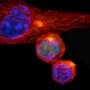
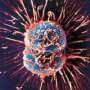
当免疫T细胞分裂成两个子细胞,一种叫做mTORC1的酶的活性,控制蛋白质的生产,后代之间的分割不均匀,产生两个细胞具有不同的属性。这种“不对称分裂,”约翰霍普金斯Kimmel癌症中心研究人员发现使用实验室培养的细胞和特殊培育的老鼠,可以提供新的方法来提高癌症免疫疗法和其他可能对研究干细胞分化的影响。
他们的研究结果表明,6月的问题自然免疫学表明不均匀mTORC1分工重组子细胞,因此继续成为一个活跃的免疫系统杀手T细胞,另一个成为一个持续的记忆T细胞,提供一个恒定的抗原T细胞可以识别威胁就像感染和癌症细胞和激活免疫反应。
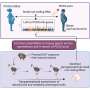
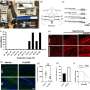
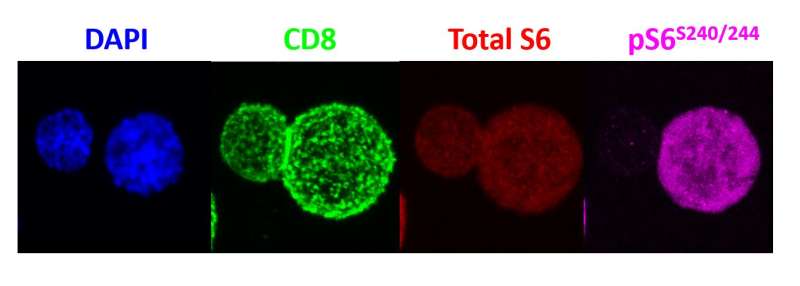
鲍威尔和他的同事们在老鼠身上的实验表明,当一个天真的“母亲”T细胞免疫威胁遇到这样的威胁和分裂时,它的一个女儿细胞继承更mTORC1活动相比,其他的子细胞。mTORC1活动水平的差异之间的两个子细胞varied-some是2到3倍和10倍的人口导致细胞进行了研究。
他说,这种不平衡分布,似乎重新编程的使用能源和其他每个子细胞的代谢活动,高度活跃的女儿继续产生活跃的免疫系统杀手,叫做效应T细胞,而低活性的女儿产生记忆T细胞。
”的一个关键步骤需要改善癌症免疫疗法通常是找到办法使T细胞抗肿瘤持续或挂在身体更长,”乔纳森·鲍威尔说,医学博士博士,肿瘤学教授约翰·霍普金斯大学医学院的副主任和其Bloomberg-Kimmel研究所癌症免疫疗法。
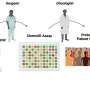
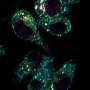
为了确定mTORC1的不均匀分布,科学家们与特定的刺激激活小鼠T细胞抗原(病毒在这种情况下)。一旦激活,T细胞分裂,科学家利用抗体来检测mTORC1在每个子细胞的酶活性。然后,鲍威尔和他的团队进行排序子细胞并分析了其功能通过注射到小鼠两个相同的感染和跟踪细胞的活动。高水平的细胞mTORC1活动被发现是有说服力地激活,杀手/效应T细胞,而细胞与低mTORC1水平表现得像记忆T细胞,持续长时间,对再感染迅速激活。
最重要的一个方面的发现,研究人员注意到,是不对称的前景分割mTORC1跨细胞在许多生物系统可能是广泛的。鲍威尔说,这是可能的机制可能有助于解释干细胞发展成更专门的细胞在骨髓中,例如,或者从一个另一个细胞如何分化成为头发、皮肤、肝脏和大脑细胞在不断增长的胚胎。“我们认为会有生物学意义远远超出了免疫系统,”鲍威尔说。
更多信息:克里斯汀N Pollizzi et al。不对称继承mTORC1激酶活性在部门规定CD8 + T细胞分化,自然免疫学(2016)。DOI: 10.1038 / ni.3438