更新的测试指南使更多女性有资格使用赫赛汀,但受益不确定
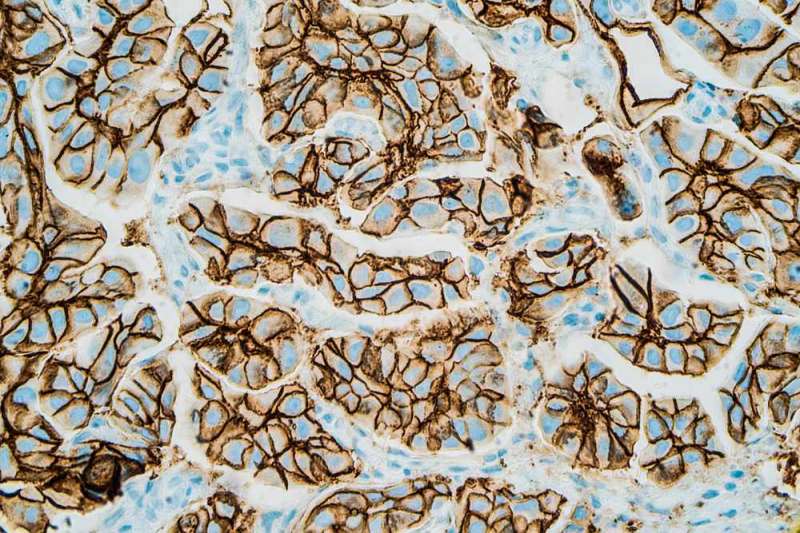
根据梅奥诊所研究人员发表在《美国医学杂志》上的一项新研究,2013年乳腺癌HER2检测指南的变化显著增加了HER2检测阳性的患者数量临床肿瘤学杂志.具有过量HER2蛋白或HER2基因额外副本的癌症被称为HER2阳性,可以用靶向HER2的赫赛汀等药物治疗。HER2代表人类表皮生长因子受体2。
梅奥诊所的研究人员发现,2013年美国临床肿瘤学会/美国病理学家学院(ASCO/CAP)修改了检测指南后,her2阳性乳腺癌的数量翻了一番。“新的指导方针是为了减少模棱两可的病例,其中HER2状态是不确定的,但我们发现他们做的恰恰相反,”高级研究作者罗伯特·詹金斯说,他是医学博士,也是梅奥诊所个体化医学研究的Ting Tsung和Wei Fong Chao教授和实验室医学和病理学教授。“模棱两可的病例增加了,导致更多的女性癌症患者最终被标记为her2阳性。
根据Breastcancer.org网站的数据,超过10%的女性会患上乳腺癌乳腺癌在他们有生之年。仅在美国,美国癌症协会估计就会有超过24.6万例新的癌症病例浸润性乳腺癌今年确诊的还有61000例非侵入性乳腺癌新病例。所有新诊断的乳腺癌都进行了人类表皮生长因子受体2 (HER2)的检测,HER2是一种促进癌细胞生长的分子癌症细胞.her2阳性癌症往往比其他乳腺癌更具侵略性,扩散速度更快。
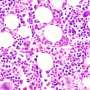
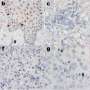
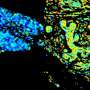
詹金斯博士说,曲妥珠单抗(赫赛汀)和拉帕替尼(Tykerb)等靶向HER2的药物的开发,极大地改善了HER2阳性乳腺癌患者的预后,但尚不清楚癌细胞上需要多少水平的HER2才能使这些靶向治疗有效。因此,他说,临床医生准确地确定特定癌症的HER2状态是至关重要的。HER2检测使用两种方法进行:免疫组织化学,检测癌细胞上存在多少HER2蛋白,荧光原位杂交(FISH),测量每个细胞内有多少HER2基因副本。
美国食品和药物管理局(FDA)于1998年批准了第一个用于确定乳腺癌HER2定向治疗资格的HER2检测指南。美国临床肿瘤学会/美国病理学家学院于2007年发布了一套新的指南(AC2007),并于2013年进行了更新(AC2013)。最新的指南改变了对模棱两可和阳性病例的分界点。
詹金斯博士和他的同事们假设,AC2013中概述的新标准将导致her2检测阳性的乳腺癌数量增加。他们分析了2013年11月至2014年10月期间转介到梅奥诊所细胞遗传学实验室进行FISH检测的2851例乳腺癌病例的FISH结果,然后使用三种指南比较了HER2 FISH扩增的患病率。
在他们的分析中,研究人员发现,与FDA标准(13.1%)或AC2007(11%)相比,使用AC2013(23.6%)解释的HER2 fish阳性病例的比例几乎翻了一番。梅奥研究人员此前在2000年的临床实践中使用FDA标准报告了13%的her2阳性率,并且在AC2013实施之前,该比率一直保持不变。自AC2013实施以来,额外的10- 15%的乳腺癌女性被认为符合her2定向治疗的条件,尽管尚不清楚她们是否会从增加的her2定向治疗中受益。
“收到假阳性结果的女性不仅面临her2定向治疗的风险,而且还错过了可能有效对抗癌症的治疗方法。这与个性化医疗的目标背道而驰,个性化医疗的目标是在正确的时间给正确的病人服用正确的药物,”詹金斯博士说。“考虑到这些靶向治疗的医学、经济和心理社会方面,我们前瞻性地确定最理想的治疗方案是谨慎的。”
詹金斯博士说,最近的国家外科辅助乳房和肠道项目B-47试验可以深入了解AC2013标记为her2阳性的额外患者是否真的会受益于her2定向治疗。最终,他说,只有在仔细考虑患者和医生的风险和收益,以及从其他HER2检测结果(包括免疫组织化学)中收集到的任何额外信息后,才应该决定使用这种靶向治疗。