基因组的非编码部分被发现在癌症中起作用
人体会产生10万种或更多不同的蛋白质。然而,令人惊讶的是,只有2%的人类基因组能够编码蛋白质。其余近80%的基因组转录成不编码蛋白质的RNA。科学家面临的两个大问题是:这种“非编码”RNA中有多少是真正有功能的?它在疾病中起作用吗?
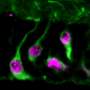
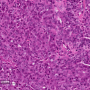
冷泉港实验室(CSHL)的一组科学家筛选了数千种非编码rna,以找到在两种侵袭性乳腺癌中高水平表达的rna。正如他们今天在一篇发表于细胞的报道,当他们降低来自乳腺肿瘤样本中这些最过表达的rna的水平时,癌症扩散的细胞特征显著降低。
在为数不多的几种不同类型的非编码RNA中,数量最多、理解最少的是长链非编码RNA (lncRNAs)。大约16000个lncrna已经在人类中被识别出来,但其中绝大多数的功能尚不清楚。
“由于如此多的基因组被转录成RNA,似乎有大量潜在的治疗靶点还没有被真正研究,”团队领导,CSHL教授David Spector说,他也是实验室的研究主任。
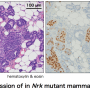
虽然大多数lncrna的确切功能仍有待发现,但已经有研究表明,在某些情况下,它们的过表达与特定癌症有关,包括乳腺癌、前列腺癌和白血病。今年早些时候,斯派特的团队证明了这一点一个lncRNA叫Malat1是乳腺癌进展的关键调节因子吗。在腔性B乳腺癌小鼠模型中,消除这一特殊的lncRNA会导致原发肿瘤内的细胞改变特征,并导致转移的显著减少。
“这项研究为我们寻找其他可能过表达并产生影响的lncrna提供了重要的动机乳腺癌,”斯佩克特说。
在博士后Sarah Diermeier的带领下,Spector和他的团队系统地筛选了大量的lncrna数据库,以确定那些相对于正常乳腺细胞而言,在肿瘤中表达更频繁的lncrna。
研究小组发现,在他们测试的两种侵袭性小鼠肿瘤中,数百种lncrna的表达均高于正常水平:管腔B和Her-2阳性。然后,他们进行了广泛的计算分析,对这些lncrna中的30个子集进行了优先排序,他们将这些lncrna称为乳腺肿瘤相关rna,或MaTARs。
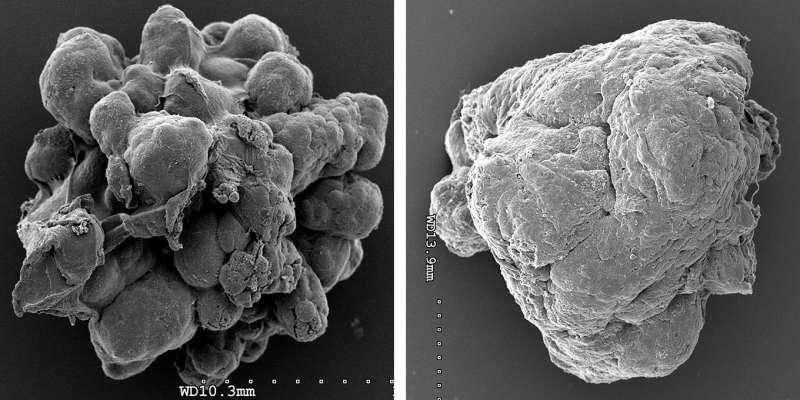
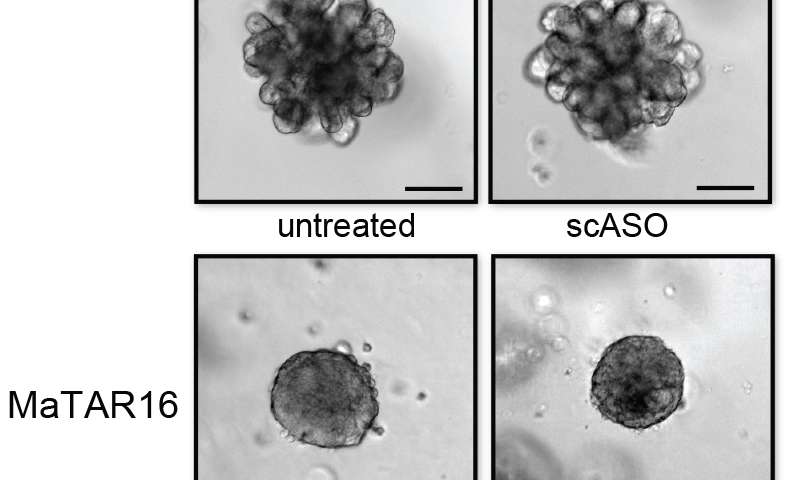
在与Ionis制药公司的合作中,Spector和他的同事们设计了一系列能与特定RNA序列紧密结合并由此破坏的分子。他们使用这些所谓的“反义”分子来清除乳腺癌衍生类器官中的个体matar,类器官是肿瘤细胞的三维模型,代表了真实肿瘤的许多特征。
研究人员发现,单独去除这些类器官中30种matar中的20种会减少与癌症相关的特征,包括细胞增殖、侵袭和迁移。
Spector说:“我们现在有了一种创新的方法来摧毁活细胞内的RNA目标,并评估肿瘤是否依赖它们生存。”
该团队的下一步是通过管理反义分子来降解小鼠体内的特定的matar,希望这种情况能够减少原发肿瘤质量和/或转移。如果这些实验成功,Spector的团队将在人类肿瘤样本中进行额外的临床前测试,以更好地确定哪些患者亚组将从使用反义分子治疗根除某些lncrna或lncrna簇中受益最大。
“我们认为这些测试将为个性化医疗具有特殊的意义,”研究第一作者Diermeier说“我们想象情况瀑样可以来源于个体的肿瘤,在培养皿中长大,和作为一个平台,找出反义分子组成的最佳治疗一个病人。”
该研究由国家癌症研究所资助的5po1ca013106项目3、曼哈塞特妇女对抗乳腺癌联盟、西蒙斯基金会和癌症中心资助冷泉港实验室(2P30CA45508)。
“乳腺肿瘤相关rna影响肿瘤细胞增殖、侵袭和迁移,”2016年9月27日在线发表细胞的报道。作者:Sarah D. Diermeier, Kung-Chi Chang, Susan M. Freier, Junyan Song, Osama El Demerdash,亚历山大Krasnitz, Frank Rigo, C. Frank Bennet和David L. Spector。该文件可在http://www.cell.com/cell-reports/newarticles







用户评论