新的研究将神经素2缺乏与炎症引起的水肿和淋巴水肿联系起来
液体积累和肿胀(水肿)可能是由于控制体内血管通透性的调节过程失灵所致。水肿常发生在银屑病、湿疹等慢性炎症性疾病中。淋巴系统中的毛细血管通常会排出多余的液体,但它们的功能障碍会导致另一种严重的情况:淋巴水肿。一项新研究发表在美国病理学杂志发现血管内皮细胞中神经素2 (Nrp2)受体的缺乏导致炎症后过量和长时间的液体积聚。这一发现可能会指导研究人员找到治疗水肿和淋巴水肿的新药物疗法。
首席研究员Diane R. Bielenberg博士的最新研究以一个转折开始。Bielenberg是哈佛医学院和波士顿儿童医院(Boston Children’s Hospital)血管生物学项目外科的助理教授,他描述了以前抑制血管内皮生长因子受体(VEGFRs, Nrp2的共受体)的研究如何显示炎症后血管通透性降低。Bielenberg解释说:“因此,我们预计在神经蛋白酶2 (Nrp2)敲除小鼠炎症后,其通透性会降低。”令她的团队惊讶的是,Nrp2基因敲除小鼠在炎症后出现了大量增加和延长的水肿。对这一发现的调查导致Bielenberg的实验室提出了一个新的假设——内源性信号素3F (Sema3F)蛋白通过Nrp2作用,抑制血管通透性和水肿。更多的实验和数据支持这一新假设。
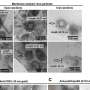
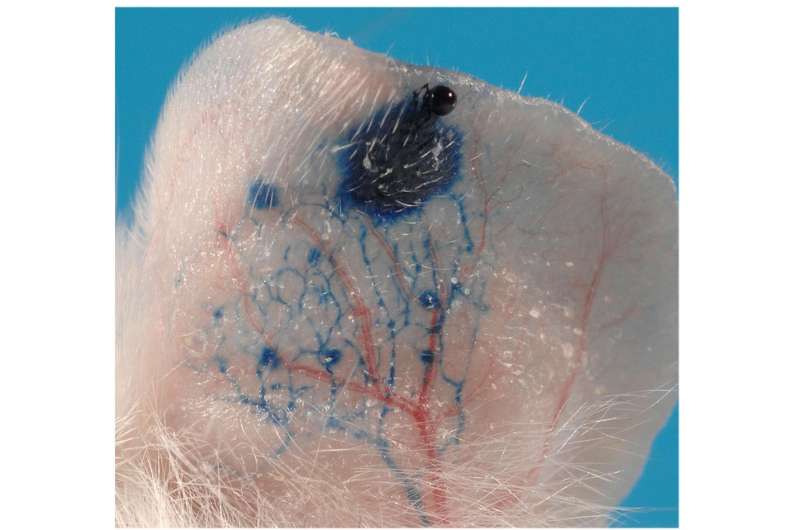
在局部引入一种引起炎症的物质后,研究人员测量了小鼠的耳朵肿胀。缺乏nrp2的小鼠的液体滞留比对照组高2.5倍。肿胀控制老鼠炎症在两天后开始消退,并在四天后恢复到接近正常水平。相比之下,在超过10天的时间里,nrp2缺陷小鼠的肿胀水平仍明显高于对照组。
研究人员还发现,在nrp2突变小鼠中,缺乏浅表淋巴管丛导致液体排出受损。波士顿儿童医院血管生物学项目的共同研究人员Patrick Mucka和Nicholas Levonyak解释说,在Nrp2中看到的长时间淋巴水肿基因敲除小鼠可能是由于发育过程中淋巴管发芽不当造成的结构缺陷。
有趣的是,nrp2缺陷小鼠的泄漏增强与内源性Sema3F活性的丧失相关。Sema3F与VEGFA竞争与Nrp2结合,因此被称为Nrp2的抑制配体。这种竞争性抑制反过来又会阻止血管通透性.因此,添加外源性Sema3F蛋白可以抑制水肿。Bielenberg博士鼓励未来对Sema3F/Nrp2轴在慢性炎症或淋巴水肿中的作用进行研究。尽管这些研究是在小鼠身上进行的,但在原发性淋巴水肿患者中已经发现了人类NRP2基因的突变。这种基因保存表明,在这一过程背后,人类和老鼠极有可能共享相似的分子机制,这对这些发现的转化是一个鼓舞人心的迹象。