精神分裂症干细胞不能正常分化为神经元
日本理研脑科学研究所的研究人员使用人类诱导多能干细胞(hiPSCs)来确定精神分裂症患者大脑发育异常的特征。发表在转化精神病学这项研究表明,缺失一种已知与精神分裂症有关的特定基因如何导致神经元的异常分化,以及大脑中神经元和星形胶质细胞数量之间的失衡。
虽然许多遗传因素导致精神分裂症,但22号染色体上一个区域的小缺失被认为是一种特殊的风险,因为该位置的几个基因参与了精神分裂症的发育和功能神经元在大脑里。为了研究精神分裂症患者大脑发育是如何因该区域的基因缺失而改变的,由吉川武夫(Takeo Yoshikawa)领导的团队利用了现代干细胞技术。研究人员从没有精神分裂症的人和有这种缺失的精神分裂症患者身上提取了hiPSCs,并比较了不同的hiPSCs如何发育成神经元。
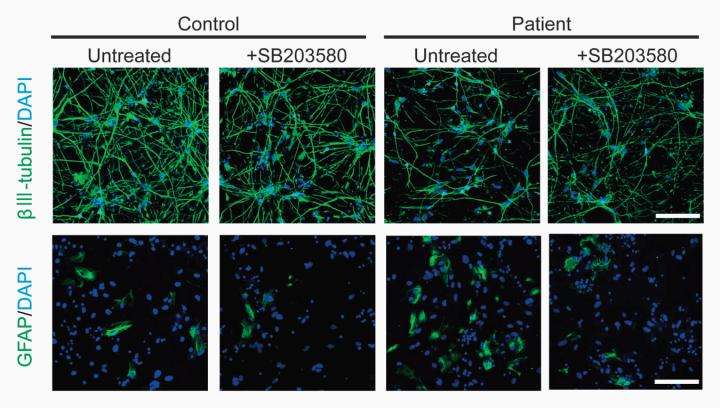
吉川解释说:“当我们分析hiPSCs时,我们发现患者来源的细胞分化成更少的神经元和更多的星形胶质细胞。然后,我们进一步确定了这些神经源性和胶质原性变化背后的分子机制。”
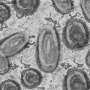
当研究神经元分化时干细胞在美国,科学家们经常生成神经球——培养中的细胞集群神经干细胞和祖细胞。研究小组注意到的第一件事是,来自患者来源的hiPSCs的神经球平均比正常小30%。
由于神经球中的细胞可以变成神经元或胶质细胞(另一种类型的脑细胞),研究小组还研究了从不同组hiPSCs中发育出来的神经元和胶质细胞的比例。他们发现,患者来源的神经球分化成的神经元比正常情况下少10%,而星形胶质细胞(一种胶质细胞)多13%。
研究人员随后将研究重点放在基因上DGCR8因为它位于22号染色体上的特殊区域,当在小鼠中被删除时,也会导致更小的神经球。在确认之后DGCR8与对照组相比,患者源性神经球的表达更少,他们表明其缺失与p38α蛋白的更高表达有关,该蛋白已知会影响干细胞的神经/胶质能力。通过抑制蛋白MAPK14抑制p38α活性增加了从患者源性神经球发育的神经元数量,并减少了星形胶质细胞的数量。
为了确定这种特征是否适用于精神分裂症患者,他们检查了精神分裂症患者死后的大脑。他们发现,与没有精神分裂症的人死后的大脑相比,这些大脑的额叶皮层含有明显更多的星形胶质细胞标记,而神经元标记则明显更少。
吉川说:“我们使用MAPK14抑制剂改善了较低的神经源性-糖原性能力。”“这些结果表明,如果我们能确定适当的给药时间,也许是精神分裂症的早期前驱期,MAPK14抑制剂可能是一种有效的治疗方法。”
然而,吉川警告说,这里发现的分子机制可能并不适用于所有的精神分裂症病例。“我们从精神分裂症患者身上提取的iPS细胞可能是一个特例,因为它们包括22号染色体的基因组缺失,通过MAPK14,导致神经元/星形胶质细胞发育不平衡。然而,在更普遍的情况下,同样类型的不平衡可能有其他方式形成精神分裂症。"
进一步探索