科学家分析重复蛋白与神经系统疾病
赖斯大学的科学家们已经发现了新的细节如何重复基因的核苷酸序列的突变蛋白可能会触发杭丁顿氏症和其他神经系统疾病。
赖斯理论生物物理学中心的研究人员利用计算机模型来分析蛋白质错误折叠的嫌疑,在患者的大脑形成斑块神经系统疾病。他们的模拟实验结果证实其他实验室受到多麸醯胺酸显示重复的长度序列包含在蛋白质对于疾病的发生是至关重要的。
研究水稻bioscientist彼得Wolynes出现在美国化学学会杂志》上。
谷氨酰胺的氨基酸编码基因CAG三核苷酸。叫做polyglutamines重复谷氨酰胺,是正常的杭丁顿蛋白的蛋白质,但当DNA复制错误,重复序列的谷氨酰胺可以变得太长了。结果可以是疾病,如亨廷顿氏舞蹈症或脊髓小脑的共济失调。
的重复次数谷氨酰胺可以成长为遗传编码信息是通过一代又一代传下来的。这意味着健康的父母的杭丁顿蛋白基因编码蛋白与35和36重复重复可能会产生一个孩子。一个人拥有再重复开发亨廷顿氏舞蹈症。
连锁聚合在亨廷顿氏舞蹈症通常开始受到多麸醯胺酸只有当达到临界长度的36个重复。研究已经证明,不再重复链可以使疾病更严重,其发病。
本文建立在早先研究中使用的技术淀粉样β蛋白。研究实验室的第一次尝试模型淀粉样蛋白聚合的能源格局,已与阿尔茨海默氏症。
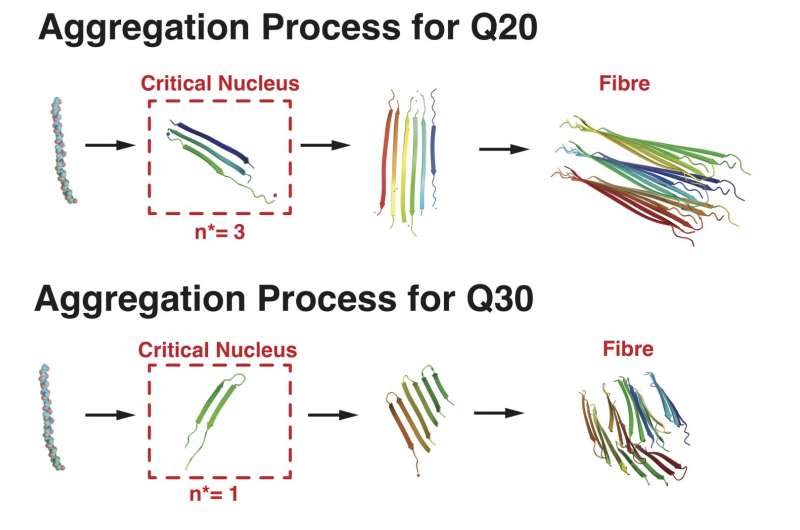
这次,Wolynes和他的团队很感兴趣了解不同长度的repeats-as几个20和多达50-influenced聚集形成的。
“蛋白质的最终形式在亨廷顿氏舞蹈症的人发现是一个宏观总体由许多分子,就像一个冰晶体形成的水有很多分子,“Wolynes说。”这个过程需要从某个地方开始,这将是核,最小集群,将能够完成过程和成长宏观尺寸。
“人们知道重复的长度与疾病的严重程度相关,但我们想知道为什么重要的关键核大小,”他说。
实验已经证明,20个重复序列或少依然展开——或者“noodle-y,”Wolynes描述;他们能够聚集成核只有在四个或更多聚集在接近。
研究者的仿真表明30或更多的重复序列能够折叠本身没有伙伴成发夹的形状,这是麻烦的聚合物的构建块。因此,对于序列的时间越长,甚至一个单一的蛋白质可以聚合过程中,特别是在高浓度。
大米的团队发现,在中间的长度在20到30之间重复,polyglutamine序列可以选择直接或发夹配置。而长和短纤维束排列序列形式,模拟显示中间序列更容易形成无序,分支结构。
“我们不知道如果分支是好还是坏,”Wolynes说。“但它解释了奇怪的形状在试管实验得到。”
受到多麸醯胺酸突变,将鼓励序列继续展开将提高聚合的能量势垒,他们发现。“具有讽刺意味的是,尽管亨廷顿氏被分类为一种错误折叠的疾病,它似乎发生,因为蛋白质,再重复在坏的情况下,进行一个额外的折叠过程,这不是应该做的,”Wolynes说。
这个团队现在正在进行的研究是观察完整的杭丁顿蛋白,其中包含部分受到多麸醯胺酸除了重复,骨料。
更多信息:Mingchen Chen等人受到多麸醯胺酸的聚合自由能景观重复,美国化学学会杂志》上(2016)。DOI: 10.1021 / jacs.6b08665