干细胞为耳聋提供良好的体外模型
协作,包括顺天堂大学的研究人员展示了从干细胞分化成特化细胞被认为是最重要的治疗遗传性耳聋的治疗目标。
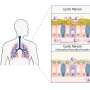
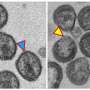
1000年,一个孩子遭受耳聋或听力损失,和听力是最受先天性疾病的常识。耳聋出生时通常是在一个特定的基因突变引起的称为缝隙连接Beta 2 (GJB2),编码蛋白质的联接蛋白26。在某些人群中,基因的突变是负责多达一半的先天性听力损失的实例。现在,Kazusaku Kamiya和最近的一份报告的合著者展示的手段生产供应这些细胞用于治疗研究的需求。
“人类耳蜗细胞不容易接近进行活检或直接药品管理局由于解剖的限制,“国家研究人员在他们的报告中。“因此,ES / iPS(胚胎干细胞或诱导多功能干细胞)细胞是研究的一个重要工具内耳病理的分子机制以及生成细胞替代疗法。”
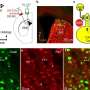
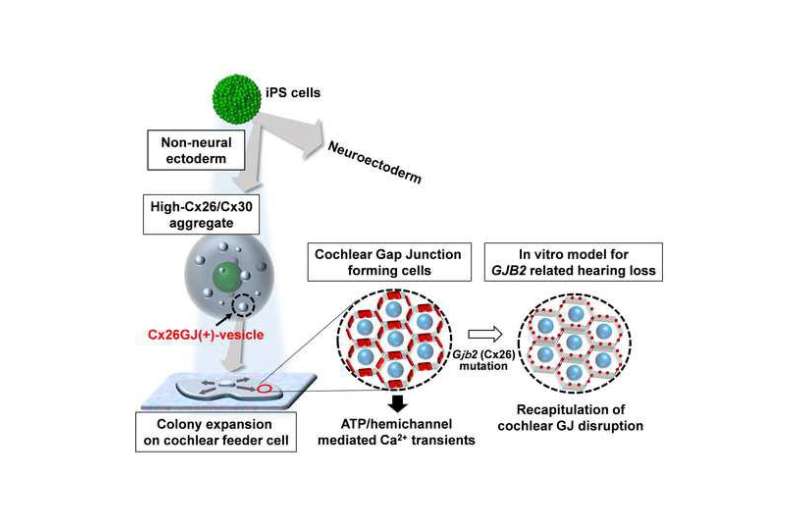
培养的细胞,研究人员跟踪调查了标准协议前7天,此时添加特定的蛋白质增加连接素的mRNA表达。在7 ~ 11天,细胞被转移到一个平面二维文化与内耳细胞尤其是耐酶分解蛋白质。他们成功地培养诱导多功能干细胞分化成缝隙连接斑细胞表达联接蛋白26。
研究人员也能够证明他们的stem-cell-derived缝隙连接细胞功能和结构特征的耳蜗细胞。重要的是,老鼠的细胞分化缺乏联接蛋白26复制先天性听力损失的细胞特征。研究人员得出结论,“预计,这些iPS派生细胞可以从患者获得,将特别有用的药物筛选和内耳细胞疗法针对GJB2-related听力损失。”
更多信息:一郎的巨大et al . GJB2-Related听力损失的体外模型概括Ca2 +瞬态通过缝隙连接的特点发展耳蜗,干细胞的报道(2016)。DOI: 10.1016 / j.stemcr.2016.10.005