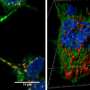
在帕金森病解开原纤维形成和分离
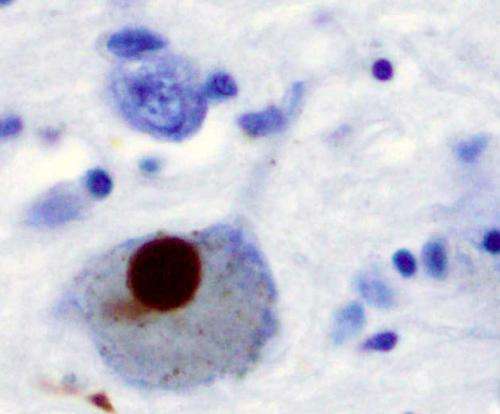
朊病毒是错误折叠的蛋白质。朊病毒的祖蛋白质的复杂三维结构改变,导致故障。更糟糕的是,这些祖为朊病毒蛋白质的畸形导致它们聚合成淀粉样斑块,可能导致疾病的状态。朊病毒负责protein-caused感染性神经退行性疾病如疯牛病和痒病的牲畜。
最近,蛋白质α-synuclein(α-syn)与朊病毒祖。在正常状态下,蛋白质是发现在神经元的突触前终端,从哪些被称为神经递质的化学信号从一个神经元释放从神经元到下一个或一个器官或其他组织类型。具体来说,α-syn参与多巴胺神经系统内运输。但是当像朊病毒,α-syn纤维聚合成不规则结构神经元的疏水核称为路易小体。后者已经涉及到神经退行性运动系统障碍的帕金森病(PD),包括常染色体显性形式的PD与已知的基因突变A30P相关联,A53T E46K。尽管PD被认为是prion-like疾病,目前还没有研究提供了一个明确的致病原纤维是如何形成和传播在PD患者的大脑。
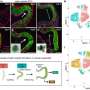
Jerson利马Silva领导的研究小组在里约热内卢联邦大学,巴西,研究致病性α-syn原纤维斑块结构在原子尺度以及他们如何行动。在这项研究中,11月30日发表在《华尔街日报》科学报告,展示了如何分裂α-syn原纤维的压力,就像那些路易小体,成单体。剩下的纤维比正常α-synuclein携带不同的特性。
席尔瓦的小组使用高的静水压力(水马力),这一过程也用来保护和消毒的食物,用高压水泵。实验室技术已经被证明是一个有用的工具,因为它可以从常规展开蛋白质折叠结构,让它回到原来的形式。技术显示的所有步骤的过程中蛋白质折叠和展开,仿佛他们构建一个折纸图说明。席尔瓦的团队与核磁共振(NMR)谱耦合水马力,第一次的照片在一个会发生什么原子尺度。
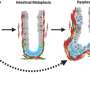
核磁共振表明,水马力技术迫使水的疏水核心内正常α-synuclein纤维,使其分离成动态改性单体,是隐状态未检测到。生成单体的过程中留下一串轻微修改原纤维,然后播种α-syn聚合的能力,一种生物现象观察到不正常的朊病毒疾病的蛋白诱发他们的正常的对应转换为异常的形式。有趣的是,没有低聚物,这通常与有毒物种在许多有关朊病毒疾病被检测到。这些都是真正的突破,因为尽管PD被认为是prion-like疾病,这是第一个证据显示神经毒性播种机制PD中观察到。
通过复制的蛋白质的结构形式中发现的疾病状态,然后恢复蛋白质回它运转正常配置,席尔瓦的团队希望援助发展的新策略来治疗帕金森病。具体地说,研究小组认为,研究可能提供一个办法阻止新α-synuclein聚合的形成,甚至可能阻止它开始。进一步,可用于信号帕金森的开端疾病标记,因此可用于早期诊断。“水马力是一个潜在的工具为开发新一代的目标物种和药物筛选研究,”席尔瓦说。事实上,这项研究首次揭示了分子细节的疏水作用和water-excluded蛀牙的形成会引起纤维的组装和稳定在PD的理解是至关重要的发展新策略阻止有毒物种和中和原纤维传播患有帕金森症的大脑中。
更多信息:结构基础的离解α-synuclein原纤维由疏水核心的压力扰动,科学报告,DOI: 10.1038 / srep37990