DNA模式可以释放葡萄糖代谢驱动癌症,研究发现
不那么咄咄逼人已知癌症是一个完整的基因组完整基因的细胞之中,而更具侵略性癌症的基因倾向于有一个很大的异常。现在,一项新的多年研究肿瘤细胞的DNA模式表明,这些异常的基因签名不是随机的,但反映了肿瘤选择性力量进化。结果也表明这些变化驱动细胞内葡萄糖代谢,改善健康的肿瘤,会导致加速肿瘤的生长。
这项新的研究是由资深作者托马斯·格雷柏博士,分子和医学药理学教授、加州大学洛杉矶分校Jonsson综合癌症中心的癌症纳米技术计划。第一作者尼古拉斯·格雷厄姆博士,助理教授在南加州大学维特比工程学院化学工程博士Aspram Minasyan,加州大学洛杉矶分校的嘎吱声研究所博士后的分子成像。
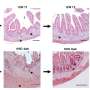
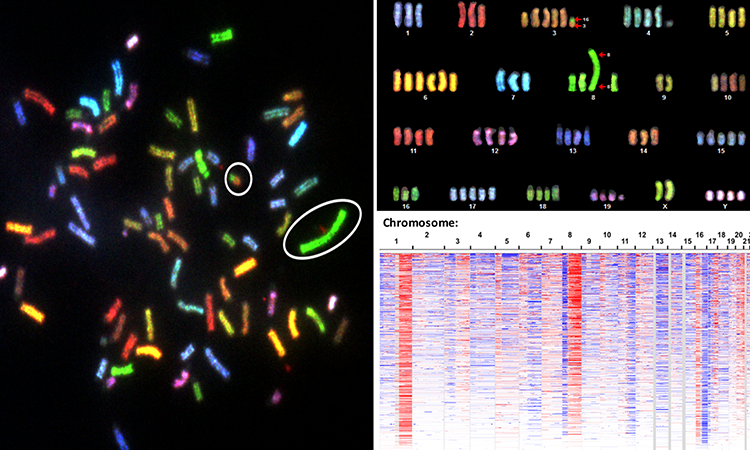
拷贝数改变(CNA)测量是用来描述肿瘤在各种各样的癌症通过寻找反复出现的模式在DNA的基因是如何放大或删除。现代研究主要集中在个体癌症基因DNA突变的主要目标和拷贝数变异还专门致癌基因(突变或放大时就像卡在油门踏板,可以把健康细胞进入肿瘤细胞)和肿瘤抑制基因(当不正常工作就像一个破碎的刹车踏板或失踪,使细胞生长失控)。然而,科学家们继续观察许多CNA复发模式在肿瘤不能完全解释这些规范的癌症基因。
它早就知道,一个根本的区别健康的细胞和tumor-forming细胞重新编程细胞新陈代谢。一个改变新陈代谢好处转化细胞在许多方面,特别是在将葡萄糖转化为能量的能力。这一过程,称为糖酵解,燃料肿瘤的生长,也可以用于检测肿瘤PET成像。研究进一步表明强烈的相关性更高水平的糖酵解活性和最激进的癌症。结果将这些方面与癌症的基因组中断通过证明以前不明原因复发性CNA模式反映了葡萄糖代谢作为基因的选择性压力变化在许多癌症,特别是积极形式的疾病。
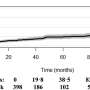
在五年的研究中,格雷柏和他的同事使用一种cross-cancer CNA数据的分析从人类肿瘤,癌症细胞系和癌症的小鼠模型。15个不同的团队分析了样本癌症。他们发现CNA的DNA扩增和删除模式预测糖酵解活动增加和快速增长肿瘤细胞。了解酶可能扮演一个角色在这个过程中,科学家们比较了CNA人类肿瘤和小鼠模型的模式。他们发现26与一致的基因改变,DNA区域包含11酶在糖酵解途径以及已知cancer-driving基因。
接下来研究者使用一种细胞永生化实验系统和基因工程直接证明糖酵解酶会影响CNA签名。通过抽样细胞在不同的时间点,研究人员能够展示这些模式演变,从而塑造癌症基因组。
这项研究是第一个使用高分辨率全基因组CNA签名识别和定义新类肿瘤的进一步补充子类定义的点突变致癌基因。与这些发现,研究人员可以构建改善癌症模型和推进治疗所有类型的疾病的发展。
”不仅仅关注这样一个数据集和已知的点突变,我们现在更好地了解微妙的组合基因改变可以影响模式葡萄糖代谢,总之关键因素最激进的癌症,”格雷柏说。“科学家们现在有了一个全新的沙盒,我们可以测试和开发的工具,将导致人们对抗这种疾病的新疗法。”
更多信息:尼古拉斯·格雷厄姆et al。DNA拷贝数改变肿瘤的复发模式反映代谢选择压力,分子系统生物学(2017)。DOI: 10.15252 / msb.20167159