潜在的新癌症治疗激活癌症吞没细胞
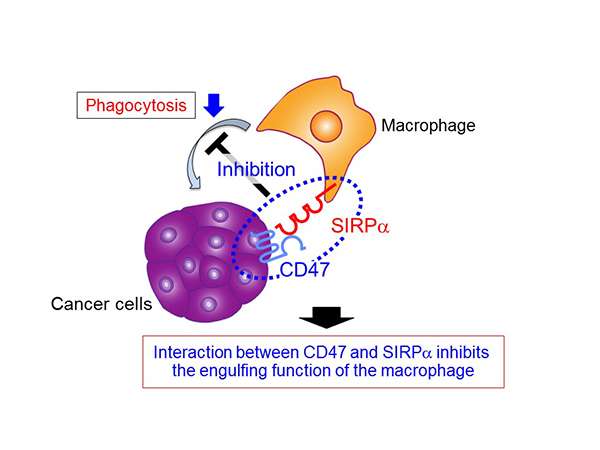
巨噬细胞是一种可吞噬和破坏癌细胞的白细胞。由Matozaki Takashi教授,副教授Murata Yoji和Yanagita Tadahiko(科比大学生物化学系和分子生物学系,分子和细胞信号传导部)领导的研究组发现,通过使用巨噬细胞发现的特定蛋白质的抗体,巨噬细胞被激活,有效地消除癌细胞。这一发现可能导致新的癌症治疗的发展。调查结果于1月12日发表在线版本JCI Insight..
癌症是世界范围内导致死亡的主要原因。近年来,针对癌细胞和健康细胞表达的特定蛋白质的治疗的有效性引起了人们的注意,包括免疫系统细胞(有针对性的治疗)。但是,这种治疗的问题包括抗靶向药物的癌细胞的出现,以及与常规的副作用不同抗癌药物.
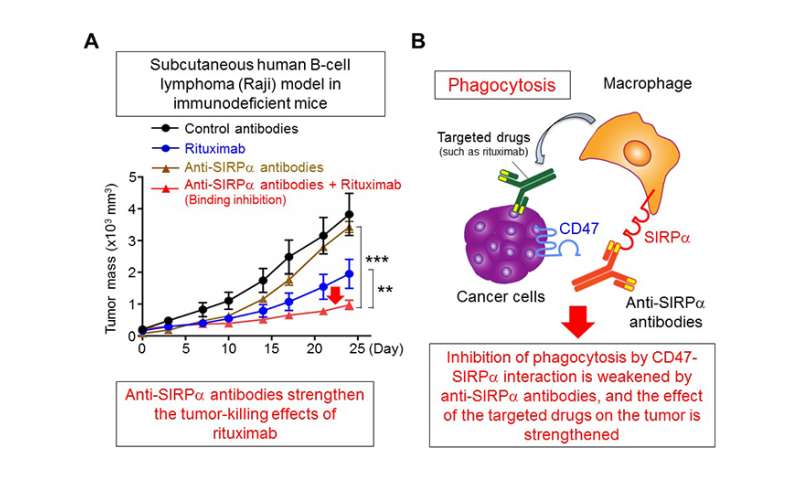
Matozaki教授的课题组在之前的研究中发现,当表达在巨噬细胞细胞膜上的蛋白SIRPα与表达在吞噬目标(如癌细胞和衰老细胞)细胞膜上的蛋白CD47相互作用时,巨噬细胞的吞噬能力被抑制(图1)。这次,使用免疫缺陷小鼠皮下注射Raji细胞(来自人b细胞淋巴瘤),研究小组发现了一种抗SIRPα抗体,它能与SIRPα特异反应,抑制CD47和SIRPα的相互作用,帮助一种叫做利妥昔单抗的靶向药物抑制肿瘤生长(图2a)。此外,他们证明了基于抗siRPα抗体抑制CD47-SiRPα相互作用,Rituximab加强了巨噬细胞的吞噬性能。研究人员得出结论,抑制CD47-SiRPα相互作用的抗siRPα抗体可以通过强化毒药如Rituximab(图2b)来强化巨噬细胞的巨噬细胞吞噬作用来高度有效。
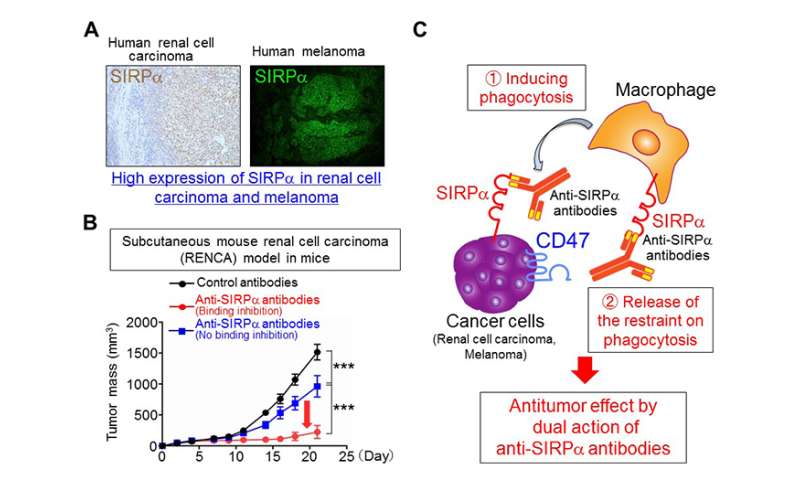
研究小组还发现两者都肾细胞癌黑素瘤在人类和小鼠中表达高水平的SIRPα(图3A)。在注射小鼠肾细胞癌(RENCA)细胞或黑色素瘤细胞的小鼠中,他们发现单独使用抗sirp α抗体可以抑制肿瘤的生长(图3B)或转移。然而,在巨噬细胞被清除的小鼠中,抗sirp α抗体对肿瘤生长的抑制作用减弱。此外,利用巨噬细胞和肾细胞或癌细胞进行吞噬实验黑色素瘤细胞,他们发现抗SIRPα抗体(1)通过直接与癌细胞上的SIRPα结合,诱导巨噬细胞吞噬癌细胞;(2)抑制CD47-SIRPα在癌细胞和巨噬细胞之间的相互作用,消除对巨噬细胞吞噬的抑制(激活巨噬细胞)。因此,他们得出结论,抗sirp α抗体对表达sirp α的癌细胞的抗肿瘤作用基于这种双重作用(图3C)。
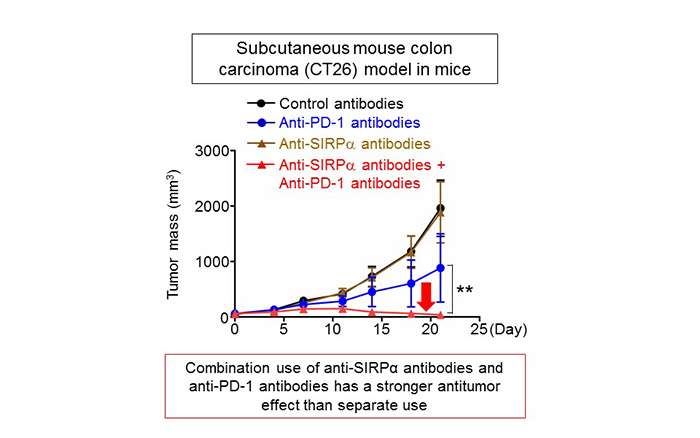
最近,抑制PD-1蛋白功能的抗PD-1抗体已经证明了抗癌药物的功效。PD-1蛋白是细胞毒性T细胞的免疫检查点分子(6)之一。在小鼠皮下植入小鼠结肠癌细胞(CT26细胞),同时施用抗SiRPα抗体和抗PD-1抗体对抑制肿瘤生长的效果较强,与其单独的给药相比(图4)。抗siRPα抗体的动作机制的细节尚不完全理解,但同时使用免疫检查点抑制剂,例如用于对细胞毒性T细胞和抗siRPα抗体作用的抗PD-1抗体具有比其更强的抗肿瘤效果单独使用。
这些发现阐明了SiRPα的抗体,一种免疫检查点分子巨噬细胞与先天免疫系统功能有关,可用作新的癌症治疗。在未来,以及分析抗siRPα抗体的抗肿瘤效应的机制更详细,同时仔细评估治疗的安全性,抗siRPα抗体可能是抗癌药物的开发。
进一步探索











用户评论