表观遗传程序导致血管分化
澄清的人类血管构造急需推进再生医学。熊本大学合作研究小组,在日本京都大学和东京大学的研究基因功能的变化发生在干细胞成为血管细胞。他们发现组蛋白代码,改变了基因的转录状态,随着时间的推移变化干细胞分化成血管反应的刺激。此外,他们发现一个转录因子组必不可少的血管分化(ETS /叫/ SOX)有一个未知的角色。
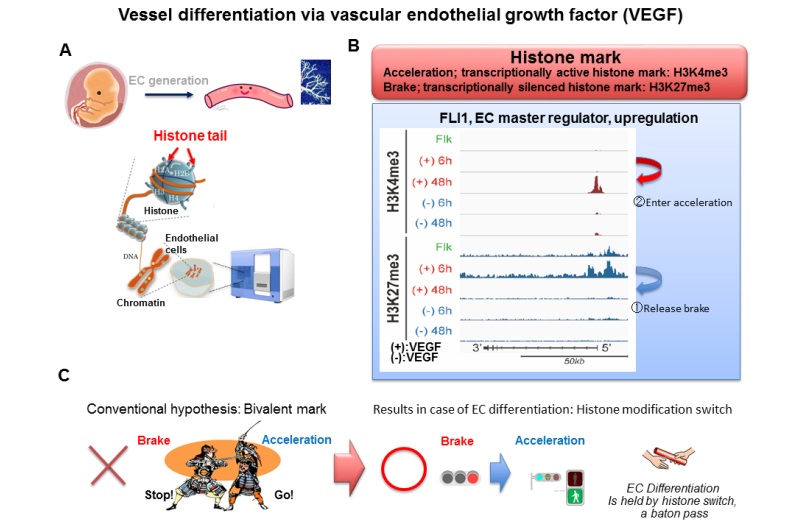
再生医学取得了举世瞩目的进步,由于研究胚胎干细胞(ES)细胞和诱导多能干细胞(iPS)细胞。然而,怎样的机制血管由这些尚未澄清的未分化细胞。在创建新血管,血管内皮生长因子(VEGF)蛋白区分干细胞成血管内皮细胞并激发他们创造新的血管。熊本大学的研究人员增加VEGF未分化的胚胎干细胞和跟踪整个基因组和表观基因组变化的行为随着时间的推移,体外。
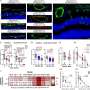
使用胚胎干细胞研发中心的iPS细胞研究和应用在京都大学(CiRA),每个细胞的研究小组收集了RNA和组蛋白后VEGF刺激(0 h),分化(6 h)之前,在分化(12 - 24小时),后分化(48小时),然后全面分析了整个基因组和表观基因组的变化使用下一代测序。
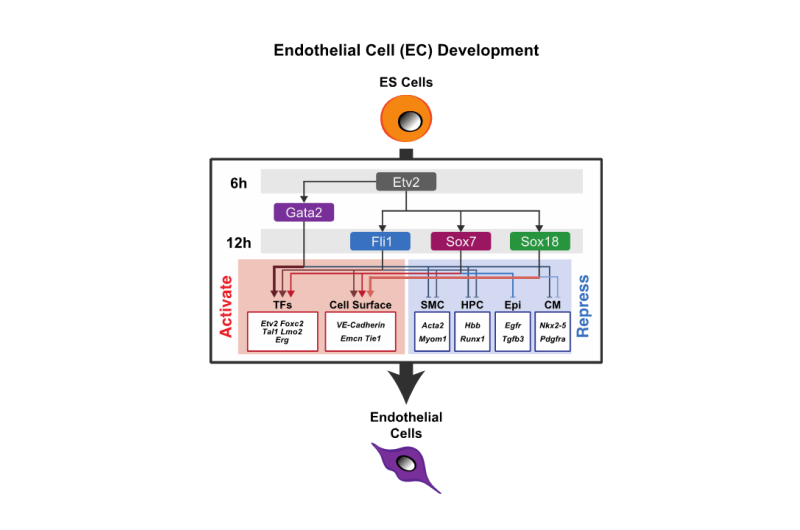
血管分化的过程中,蛋白质的功能ETS变种2 (ETV2),这决定了分化为血管内皮细胞,第一次在6小时内诱导分化的刺激。结合的蛋白质GATA2 ETV2和支持血管内皮分化,诱导之后立即。转录因子袜和FLI1重要内皮分化,诱导12到24个小时。在48小时内,分化为血管内皮细胞被确定后,系统独有的基因的转录成立血管内皮分化诱导。
此外,考试的组蛋白密码透露,监管的基因组区域转录因子(ETS /叫/ SOX)被发现已逐渐从一个“刹车组蛋白标记,”抑制转录,一个“加速器组蛋白标记,”激活转录,而分化为血管内皮细胞的过程。之前,在该地区控制转录因子的功能,促进从胚胎干细胞分化到一个特定的细胞类型,二价修改等组蛋白的转录的油门和刹车组蛋白标记共存。
此外,当这些转录因子失去功能,终端分化的血管内皮(完成分化)是完全压制,基因分化为血管内皮细胞以及关键转录因子,维持负面诱导未分化状态。集体,转录因子(ETS /叫/ SOX)不仅诱导血管内皮分化,但也抑制回归到一种未分化状态和分化到其他外胚层的或对葡萄糖的细胞。
预计这些功能的知识转录因子当结合基因编辑技术,允许有效的血管再生。
更多信息:Yasuharu Kanki et al,动态和epigenetically协调GATA / ETS /袜为内皮细胞分化转录因子表达是必不可少的,核酸的研究(2017)。DOI: 10.1093 / nar / gkx159