基因传递系统防止遗传性眼病导致视力下降
凯斯西储大学(Case Western Reserve University)的研究人员开发出一种携带基因的纳米颗粒,可以靶向靶细胞,防止人类莱伯氏先天性黑蒙小鼠视力下降。
根据美国国立卫生研究院(National Institutes of Health)的数据,这种情况是导致儿童失明的最常见原因之一,每10万新生儿中就有2到3人患有这种疾病。
虽然这项研究的重点是一种名为莱伯尔先天性黑朦2型(LCA2)的疾病,但参与这项研究的科学家和工程师相信,这项技术对其他形式的LCA以及其他导致严重黑朦的遗传性疾病有希望视力丧失或失明。
“我们相信这项技术可以传递几乎任何类型的基因来解决遗传性视觉障碍,”凯斯西储大学M. Frank和Margaret Domiter Rudy生物医学工程教授、该研究的领导者陆正荣(Zheng-Rong Lu)说。
该研究小组的研究发表在6月16日的《美国医学杂志》上分子治疗-核酸.
患有LAC2的人携带突变的RPE65基因,从出生起就患有严重的视力丧失。突变基因不能在视网膜色素上皮细胞(RPE)中产生RPE65蛋白,RPE是保护光感受器(视杆细胞和视锥细胞)的关键细胞层。这种蛋白质是视觉循环的重要组成部分,它将光转化为电信号传递给大脑。
到达目标细胞
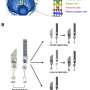
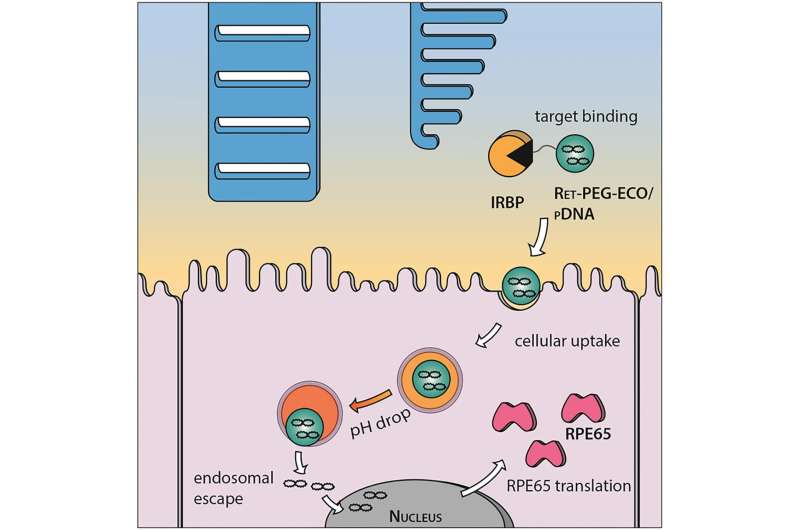
Lu和同事们设计了一种基于脂质的纳米颗粒,称为ECO,以提供健康的RPE65基因到RPE细胞。
凯斯西储医学院药理学系主任Krzysztof Palczewski说:“这项技术的前景是将药物定位在感光细胞上,使肝脏和肾脏免受暴露。”视觉科学家Palczewski和研究药物传递的Lu已经在这项研究上合作了六年。
“他有一个聪明的想法,”帕尔切夫斯基说。“这种纳米颗粒利用眼睛中存在的蛋白质作为锚点,当结合时,基因就会被传递出去。”
卢说,虽然其他研究人员专注于使用改良病毒来传递治疗用的基因,但有时基因太大,病毒无法携带。ECO可以为货物量身定做。
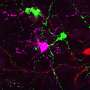
纳米颗粒的表面涂有核酸作为靶向剂,将输送系统吸引到视网膜上,促进RPE细胞的摄取。为了追踪活动,卢的团队使用了荧光标记
治疗LCA等
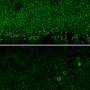
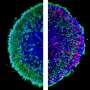
在将其注射到小鼠视网膜后,研究人员可以在RPE细胞中看到荧光绿色集中。测试显示,从眼睛到大脑的光诱导电活动显著增加,表明视杆和视锥细胞在视觉周期中正常工作。
治疗小鼠的疗效持续120天。在未经治疗的小鼠中没有观察到任何改善。
“这项工作的重要性超越了一种疾病,”Palczewski说。“失去感光细胞几乎影响了我们所有人。”
他解释说,随着年龄的增长,人们会失去大约30%的感光细胞。视网膜的疾病或损伤也会导致细胞中保护性蛋白质的丧失,从而导致额外的细胞死亡。这项技术有可能被用于保护这些老化或受损的文物细胞.
研究人员目前正在调查ECO系统是否对其他视觉障碍有效,包括Stargardt病,这是一种遗传性青少年黄斑变性,主要影响视野的中心部分。他们还在研究纳米颗粒是否可以与CRISPR/Cas9基因编辑技术一起使用,以治疗与视网膜退行性疾病相关的遗传病变。