钙依赖激酶形成新记忆的精确机制
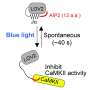
突触可塑性是一种增强或减弱突触或神经元间交流的能力。这些变化是由被称为树突刺的小神经元突起内的几种不同分子的激活所触发的。虽然脊椎的可塑性有不同的形式,但这些不同的形式都是由一个共同的信号引起的:树突棘中钙的增加。CaMKII蛋白是大脑中最丰富的蛋白激酶,在突触中尤其丰富,在突触传递、神经递质释放和突触可塑性的调节中起着至关重要的作用。通常,CaMKII是不活跃的,因为它的结合位点被阻塞,但钙去除阻塞,从而激活蛋白质。通过突触的交流导致钙离子浓度达到峰值,从而激活CaMKII。但是钙峰值模式如何转化为CaMKII活性仍然是个谜。
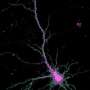
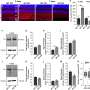
在2017年5月出版的神经元,来自Ryohei Yasuda的实验室的MPFI研究人员描述了他们如何优化现有的成像方法,以更精确地可视化Camkii激活钙水平增加。通过将荧光寿命成像的时间分辨率提高到毫秒范围,他们首次能够看到CaMKII是如何在突触可塑性中发挥作用的树突棘当钙离子在单个树突中快速连续出现时脊柱。研究人员使用激光脉冲来激活单个突触,并在小鼠脑切片中的树突刺中唤起钙尖峰,然后观看Camkii活动发生的事情。Yasuda团队发现Camkii活动响应每个脉冲而飙升,就像钙一样。但是,Camkii Spikes持续时间比钙尖峰长,并以逐步的方式组合在一起。由于信号随时间结合而结合,因此钙穗的特定模式可以转化为可变量的CAMKII活性,从而转化为突触强度和结构的不同变化。
如果CaMKII蛋白在Thr286位点磷酸化自己,它也可以独立于钙工作。这是因为自磷酸化阻止了CaMKII的结合位点再次被阻断。虽然这是CamKII功能的一个重要特征,但磷酸化如何影响CamKII钙信号的翻译仍是未知的。为了解决这个问题,安田实验室用CaMKII突变体重复了他们的实验,该突变体不能在这个位点磷酸化。突变的CaMKII活性峰值比正常的短,因此,重复突触激活诱导的活性不会随着时间的推移而增加。突触强度和结构的长期变化也受到损害。然而,通过更快地刺激突触,使CaMKII峰值能够叠加在一起,恢复了功能和结构的变化。这些结果表明,通过促进CaMKII介导的钙整合,Thr286的自磷酸化是诱导脊柱可塑性的必要条件,但磷酸化是维持脊柱可塑性的必要条件。
未来的发展方向
这是第一个报告,其在单树枝状刺的突触塑性诱导过程中显示钙依赖性激酶的精确过滤机制。本研究的观察结果阐明了Thr286磷酸化在可塑性中的关键作用:它降低了诱导所需的刺激频率突触可塑性并允许Camkii在生理相关频率下整合钙信号。这提供了针对长期猜测的直接证据,即THR286的磷酸化是长期记忆的生物化学相关性。
安田实验室的未来研究有望在理解调节记忆形成的分子信号方面取得重大进展。由于CaMKII的功能似乎在精神疾病中受到了干扰,因此利用安田实验室开发的先进成像方法对这种分子进行详细分析,可能为了解大脑疾病(如阿尔茨海默氏病)的发病机制提供重要的见解。











用户评论