CRISPR / Cas9基因编辑逆转亨廷顿在小鼠模型
扰乱一个有问题的基因在大脑细胞能扭转亨廷顿氏舞蹈症病理学和运动症状的老鼠模型继承了神经紊乱,科学家报告。
研究人员使用CRISPR / Cas9基因编辑由病毒载体,剪一个基因的一部分生产有毒蛋白质总量的九个月的老老鼠的大脑中。周后,向量应用,聚合的蛋白质几乎消失了。此外,小鼠的运动能力有所改善,尽管不是水平的控制老鼠。
结果将于6月18日公布2017年临床研究杂志。
结果打开一条治疗亨廷顿氏以及其他遗传性神经退行性疾病,虽然需要更多的安全测试和长期影响,Xiao-Jiang资深作者李说,医学博士,博士,著名的人类遗传学教授埃默里大学医学院的。
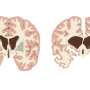
亨廷顿氏病是由一个基因编码一种有毒蛋白(突变杭丁顿蛋白或mHTT)导致脑细胞死亡。通常出现在中年和症状包括无法控制的动作,平衡问题、情绪波动和认知下降。
被广泛的潜力,CRISPR / Cas9基因编辑并没有被用来治疗任何人类神经退行性疾病。几个问题需要解决在使用它之前,如有效的交付和修补DNA脑细胞的安全。类似的基因小鼠的编辑方法,但是使用不同的技术(锌指核酸酶),据报道在2012年亨廷顿氏舞蹈症。
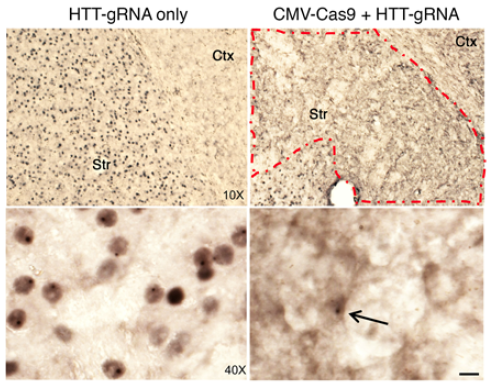
在这项研究中使用的老鼠有一个人类的变异杭丁顿蛋白基因取代鼠标杭丁顿蛋白之一基因。在这些老鼠,马达问题和聚合突变杭丁顿蛋白可以观察到在9个月的年龄。
规划基因编辑时,科学家选择引导序列,针对正常复制和disease-driving杭丁顿蛋白基因的副本。这种“non-allele特定”方法不需要定制的病人的基因组,与其他编辑建议亨廷顿氏舞蹈症基因。
艾莫利大学的研究人员曾表明,小鼠年龄超过四个月不需要杭丁顿蛋白基因保持健康,暗示治疗策略旨在关闭成年人类基因的两个副本可能是安全的。
临床研究已经开始这样的治疗,可能需要持续管理药物基因沉默。相比之下,一个基因编辑治疗可以更持久,如果它足够的细胞。
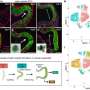
CRISPR / Cas9-guided酶进入脑细胞,研究人员利用一种广泛使用的基因治疗载体基于AAV(腺相关病毒)。科学家们将病毒载体携带CRISPR / Cas9注入的纹状体区域亨廷顿氏病模型小鼠的大脑在9个月的年龄。纹状体是大脑的一个区域,控制身体的运动和运动机能。
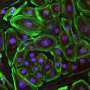
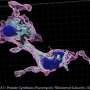
这导致将“大幅减少”聚合突变杭丁顿蛋白在三周后纹状体。这项研究揭示了脑细胞自我治愈的能力如果毒性蛋白的基因源,科学家们说。
与控制亨廷顿的老鼠相比,CRISPR / Cas9-injected小鼠有显著改善测试的马达控制,平衡和握力,尽管他们并没有恢复,以及执行控制老鼠。
解决基因安全问题,研究者显示大脑细胞移码突变引发的CRISPR / Cas9主要发生在杭丁顿蛋白的基因,而不是其他潜在的非标靶基因。
然而,长期影响和安全注射AAV的大脑表达CRISPR / Cas9仍有待严格测试前将此方法应用于病人,李说。
co-first作者论文的博士后研究人员苏阳,埃默里大学博士,吴仁宝Chang博士在遗传学和发育生物学研究所,中国科学院。
艾莫利大学的合作者包括朝晖秦博士,副教授,生物统计学,彭,博士,人类遗传学教授和李”。医学博士,人类遗传学教授。Xiao-Jiang李肇星还隶属于Guangdong-Hongkong-Macau CNS再生,研究所的暨南大学。
这项研究是由美国国家神经疾病和中风研究所(NS036232、NS101701 NS095279)和中国国家自然科学基金(批准91332206)。
更多信息:苏阳et al, CRISPR / Cas9-mediated亨廷顿的基因在小鼠模型中编辑改善神经毒性?年代的疾病,临床研究杂志(2017)。DOI: 10.1172 / JCI92087