人类酶可以减少痴呆小鼠模型中的神经毒性淀粉样蛋白
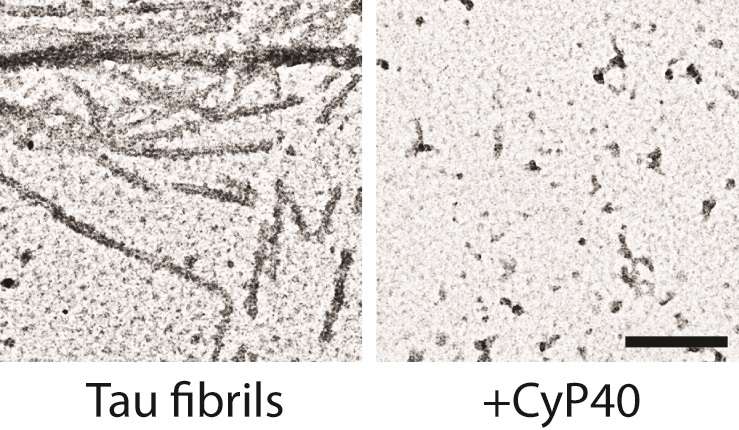
根据开放式学期间的一项研究发布,天然存在的人酶 - 可以为阿尔茨海默病和帕金森病有助于阿尔茨海默病和帕金森病的疾病,这是一种自然的人酶。PLOS生物学By Jeremy Baker,Laura Blair和南佛罗里达大学的乍得Dickey在坦帕和同事。该发现可能指出这些疾病的新治疗策略。
多数情况神经退行性疾病,错误折叠的蛋白质聚集体以形成称为淀粉样蛋白的不溶性丛。许多淀粉样蛋白在阿尔茨海默病患中的淀粉样蛋白和帕金森病中的α-突触核蛋白,含有氨基酸脯氨酸,其独特的结构诱导弯曲氨基酸链。那些弯曲有助于堆叠蛋白质的相邻区域,从而促进淀粉样蛋白形成。在正常蛋白质折叠期间,CYP40锁定在脯氨酸上,使它们定向为其特征链弯曲构象,但与大多数酶一样,它也可以反向操作,有助于不承受链子。
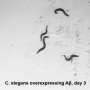
研究人员发现CYP40可以减少聚集的Tau的量,将其转化为更可溶的形式。在阿尔茨海默氏病的小鼠模型中,CYP40保存脑神经元的实验表达并救出了认知缺陷。相同的酶也分解α-突触核蛋白,与帕金森病相关的骨料。这是CYP40首次被证明可以将负责神经退行性疾病的淀粉样蛋白分解。
究竟Cyp40如何降低聚合尚未清楚,作者提供了两种可能性。酶可以结合聚集的蛋白质,并通过逆转脯氨酸弯曲,帮助解除溶解并分离氨基酸链。对该模型的支持来自观察结果,即在抑制其作用时酶在减少聚集体时较小。或者,酶可以结合蛋白质在它形成聚集体之前,隔离它并因此防止其块状物。
了解酶的确切机制的了解可能有助于指出治疗策略以脯氨酸在淀粉样蛋白形成中的作用为中心。“发现CYP40可以解释的Tau和α-突触核蛋白的丛集表明它或超过40个其他具有相似活动的人类蛋白质之一可能具有在治疗神经变性的作用疾病布莱尔说。
进一步探索










用户评论