主要研究项目探讨我们的骨骼和肌肉的年龄,如何阻止其下降的新方法

随着年龄的增长,骨骼和肌肉的形式和功能下降,使我们脆弱的风险增加和下降。
现在,研究人员在乔治亚州奥古斯塔大学医学院解剖茎发生了什么细胞使组织,帮助我们保持直立,着眼于改善我们的健寿。
骨质疏松症已经是一个重大的公共卫生问题影响了约4400万美国人,每年花费数十亿美元。世界老年人口以前所未有的速度增长了8.5%的全球人口- 6.17亿——65岁以上,这一比例预计将达到17%,到2050年,根据美国国家老龄问题研究所。
“65岁以后你开始失去肌肉和1%左右骨每年,”卡洛斯Isales博士说,内分泌学家,摄政的教授和临床事务副主席MCG神经科学和再生医学。
“日常锻炼减少下降的斜率。但我们关注的是想看看我们能否进一步平曲线,”首席研究员Isales说,一项新的930万美元项目项目从美国国立卫生研究院拨款。
时间似乎改变了间充质干细胞在骨和肌肉之间的动态和燃料的氨基酸。MCG的科学家也有证据表明它改变了干细胞互相发送信号。
底线是:我们的干细胞数量得到减少,细胞变得不那么有效,让骨骼和肌肉,往往选择简单任务的脂肪相反,Isales说。
博士团队,包括主要研究者骨生物学家马克·Hamrick干细胞研究员威廉·d·希尔博士和梅根·McGee-Lawrence博士生物医学工程师,希望保持干细胞的关注使骨骼和肌肉。
“我们正在考虑干细胞作为一个群体和发生了什么他们随着年龄的增长,”希尔说。“这包括失去方向,所以他们不像以前一样功能。我们正在考虑的另一件事是他们的生存,它们的数量。”
“我们正在试图找出为什么变化正在发生,如果我们可以针对这些细胞,使它们再次想要骨头,“McGee-Lawrence说。
骨骼和肌肉的功能是交织在一起的,所以他们的健康和促进他们的损失或生存的因素也相似,Hamrick说。
崩溃的罪魁祸首似乎是犬尿氨酸代谢的副产品必需氨基酸色氨酸。色氨酸是9个氨基酸身体不能让我们必须消耗在土耳其和大豆等食物,所以我们可以执行使蛋白质等必需品。研究人员还认为,燃料将信号发送给细胞,干细胞的衰老显然没有得到。
不健康的代谢物是一个自然的结果行动称为氧化,随时发生细胞利用氧气。尤其是随着年龄的增长,氧化产生的自由基也可以破坏细胞。犬尿氨酸酶,结果吲哚胺2,3加双氧酶,或我,各种各样的组织使帮助调节免疫反应、氧化色氨酸。随着时间的推移,犬尿氨酸成堆,似乎改变骨骼和肌肉形成的动态。
有点讽刺的是,必需氨基酸的许多功能包括抗氧化剂,所以研究者们正在一起营养鸡尾酒- -色氨酸和蛋白质含量降低,他们希望能扭转与年龄相关的损害。Isales指出,他们可能会发现其他氨基酸色氨酸在老年人环境产生相似的问题。
所以他们也采取更直接的方法像被罩抑制剂——是否已经在临床试验中作为一个癌症斗士——可以反向变化,并利用干细胞重新更年轻的函数。
为了开始看到如果他们在实验室老鼠抬起在人类身上,看到他们在这两种方法在人类干细胞检索过程中膝关节或髋关节置换的同事在MCG的骨科手术。
他们实验室的证据表明,至少在老鼠,高犬尿氨酸水平影响细胞的能力骨髓成骨细胞成骨细胞。事实上,即使是相对年轻的老鼠犬尿氨酸经验骨质流失,增加骨破坏的细胞称为破骨细胞和骨髓脂肪增加。相反,老鼠被罩淘汰保持强烈的骨量。
“你可以做一个老老鼠年轻,你可以让一个年轻的老鼠,”希尔说。
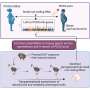
团队也有证据表明,年龄增加犬尿氨酸如何伤害的一部分是通过改变小分子核糖核酸——小而强大的RNA片段,可以同时控制成千上万基因的正常表达,以及周围的小分子核糖核酸运输囊泡分泌出来。干细胞分泌液作为沟通的一种方式,和明显衰老干细胞相互沟通不好。
“液是一种机制的细胞也不同器官之间的串扰,“Hamrick说。“肝脏生产液、脂肪产生液,他们将影响其他器官,在某些情况下,积极的消息,在某些情况下,坏消息,”Hamrick说,谁是领导这个项目恢复积极的消息。
他们实验室证据表明老化改变至少两个小分子核糖核酸,mir - 141和mir - 183,提示细胞嗜骨代替成骨细胞。再一次,他们甚至已经表明,年轻干细胞暴露于老液会假设这bone-reducing立场。但是也有一些证据表明,一些膳食干预Isales看着可能扭转不良影响。
研究小组最近在《华尔街日报》报道,组织工程,液从老和年轻老鼠相似规模和数量,都有许多microrna。但年龄液明显特别是更多mi183, microrna已经与癌症有关。在这种情况下,高mi183似乎减少细胞增殖和未成熟的细胞的能力骨细胞并能更好的支持总体恶化,随着年龄的增长,称为衰老。年龄增加活性氧和氧化应激的帮助提高mi183水平,这些不受欢迎的结果。当研究人员把间充质干细胞从老老鼠,从幼小动物液抑制形成muscle-making基因;直接给mi183骨骼和肌肉产生细胞使他们开始表演。现在他们想知道更多关于老化改变液的分泌和货物mesynchymal干细胞和如何反过来有助于骨骼和肌肉的损失。
第三个项目,由山,将关注货物,microrna,了解它们是如何影响骨形成和营业额。“我们认为,氨基酸是控制特定组微rna的表达,”希尔说。这意味着他们可能想要的目标,甚至消除键或关键的小分子核糖核酸,从而显著影响众多基因的表达。
他们也正在探索老化对基质细胞衍生因子1的影响,或SDF-1,这是重要的,它可以帮助保持干细胞的骨髓和关注使骨头。与年龄相关的变化似乎使SDF-1而不是鼓励干细胞游荡。研究人员指出,尽管这些细胞通常需要离开骨髓,说帮助治愈受伤,这些细胞与年龄相关的旅行是随机的,经常找不到路回来。一个一致的目标是确定干预的目标。
“我们的想法是,如果我们可以改变环境,改变他们自己和其他细胞信号,我们可以直接修改干细胞,”希尔说。
他们正在寻找上游早期的干预,包括组蛋白deacetylase-3正在发生什么,或HDAC3。他们有证据表明HDAC3,身体的另一个普遍的监管机构可以将基因表达上升或下降,最重要的是干细胞的与年龄相关的倾向使脂肪而不是骨头。
至少有一个原因是,减少HDAC3意味着更少的骨头,这确实让更多的脂肪,空间McGee-Lawrence说这些研究领先。她以前的研究已经表明HDAC3从骨骼中删除时,骨骼较弱,就像发生老化。
现在他们有证据表明,小鼠和犬尿氨酸治疗,例如,抑制骨HDAC3表达式。他们想知道更多关于如何HDAC3得到抑制随着年龄的增长,正是对骨形成和脂肪存储除了腾出空间。新批准允许他们将一起更好,进一步抑制HDAC3什么和什么抑制骨骼和脂肪的形成。底线是识别早期的干预和潜在的营养干预。
“一些骨头导致细胞的微环境,而不是想让骨头,它们存储大量脂肪,“McGee-Lawrence说。HDAC3一样,“这些表观遗传因素的一些环境因素,如氨基酸的变化是导致细胞功能障碍。我们希望能找出信号以及如何逆转它,使这些细胞又要开始做骨。”
同卵双胞胎的研究表明,环境因素肯定扮演一个角色,因为这些双胞胎的骨骼和肌肉健康通常都是不相同的,即使他们的基因,Isales说。而不是改变基因本身,环境因素似乎已经改变了他们的表情:哪些或关机。这些表观遗传变化包括压力因素从饮食睡眠模式时代。
有20个氨基酸,这是必不可少的蛋白质生产和各种各样的其他功能给细胞结构来帮助器官功能。Kyrurenine也是与我们大脑的退化和免疫系统随着年龄的增长。Mesynchymal干细胞还生产血液、软骨和脂肪细胞。
Isales也是临床和转化研究的副主席MCG骨科和MCG医学系的教员。Hamrick,希尔和McGee-Lawrence教员MCG的细胞生物学和解剖学。其他科学家帮助支持三个核心实验室生物统计学的相关研究包括管理核心,Maribeth约翰逊和杰Chen博士MCG生物静力学和流行病学;骨生物学核心,穆罕默德Elsalanty博士口腔生物学,牙科学院乔治亚州盟;施博士和骨骼干细胞核心,Xingming, MCG的神经科学和再生医学。