新型CRISPR-Cas9筛查能够发现新的靶点,以帮助癌症免疫治疗

Dana-Farber/波士顿儿童癌症和血液疾病中心的一个团队开发了一种新的筛查方法——使用CRISPR-Cas9基因组编辑技术来测试小鼠体内数千个肿瘤基因的功能——揭示了新的药物靶点,可能会增强PD-1检查点抑制剂的有效性,这是一种有前途的新型癌症免疫疗法。
研究结果今天在网上公布自然由儿科肿瘤学家W.尼克·海宁(W. Nick Haining)领导的丹娜-法伯/波士顿儿童医院(Dana-Farber/Boston Children’s)团队。-报告称,肿瘤细胞中Ptpn2基因的缺失使它们更容易受到PD-1检查点抑制剂的影响。PD-1阻滞剂是一种对免疫细胞“释放刹车”的药物,使它们能够定位和破坏癌症细胞.
“PD-1检查点抑制剂已经改变了许多癌症的治疗,”海宁博士说,他是这篇新论文的资深作者,也是哈佛医学院儿科副教授,麻省理工学院和哈佛大学布罗德研究所的副成员。bob电竞"尽管这种新型的癌症免疫疗法在美国,大多数患者并没有从PD-1阻断中获得临床益处。”
海宁说,这引发了一系列额外的试验,以调查其他药物与PD-1抑制剂联合使用时,是否能增加对治疗有反应的癌症患者的数量。
海宁说:“迄今为止的挑战是找到最有效的免疫治疗靶点,并优先考虑那些与PD-1抑制剂联合使用时效果最好的靶点。”“因此,我们开始开发一种更好的系统来识别新的药物靶点,这可能有助于人体自身的免疫系统攻击癌症。
海宁继续说道:“我们的工作表明,有很多生物途径可以被靶向,使免疫疗法更加成功。”“其中许多是我们无法预测的令人惊讶的途径。例如,如果没有这种筛查方法,Ptpn2是癌症免疫治疗的良好药物靶点就不会很明显。”
筛选成千上万的潜在目标
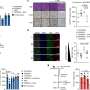
为了广泛撒网,这篇论文的第一作者Robert Manguso,海宁实验室的一名研究生,设计了一个基因筛选系统来识别癌细胞用来逃避免疫攻击的基因。他使用CRISPR-Cas9这种基因组编辑技术,就像一把分子剪刀,在遗传密码的精确位置切割DNA,系统地敲除黑色素瘤皮肤癌细胞表达的2368个基因。Manguso随后能够识别哪些基因被删除后,使癌细胞更容易受到PD-1阻断。
Manguso首先对黑色素瘤皮肤癌细胞进行改造,使它们都含有Cas9,这种“切割”酶是CRISPR编辑系统的一部分。然后,他用一种病毒作为传递载体,用不同的遗传密码“单导RNA”序列对每个细胞进行编程。与Cas9酶结合后,sgRNA编码(长度上约有20个氨基酸)使2368个不同的基因被消除。
通过将肿瘤细胞注射到小鼠体内,然后用PD-1检查点抑制剂治疗它们,Manguso能够总结出哪些经过修饰的肿瘤细胞存活了下来。由于缺失基因,那些死亡的老鼠对PD-1封锁敏感。
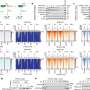
通过这种方法,Manguso和Haining首次证实了两个已知的免疫“逃避者”基因的作用——pd - l1和CD47,这两种药物抑制剂已经在临床试验中。然后,他们发现了各种新的免疫逃避因子,如果在治疗上受到抑制,可以增强PD-1癌症免疫治疗。其中一个新发现的特别有趣的基因是Ptpn2。
“Ptpn2通常会抑制免疫信号通路,否则会使其窒息癌症细胞海宁说。“删除Ptpn2会增加这些免疫信号通路,使肿瘤细胞在免疫攻击下,长得更慢,更容易死。”
扩大地盘
随着新的筛查方法的出现,海宁的团队正在迅速加大努力,寻找更多可以促进免疫治疗的新药物靶点。
海宁表示,该团队正在扩大他们的方法,从筛查数千名基因最终能够对整个基因组进行筛查,并从黑色素瘤扩展到结肠癌、肺癌、肾癌等。他召集了一个庞大的科学家团队,成员来自达纳-法伯/波士顿儿童医院和布罗德研究所,以应对伴随如此大规模筛查工作而来的技术挑战。
与此同时,还有更多新的潜力药物靶点可能即将到来,海宁的团队正在根据他们对Ptpn2的发现采取行动。
海宁说:“我们正在努力思考Ptpn2抑制剂会是什么样子。”“很容易想象制造一个小分子药物这会关闭Ptpn2。”
更多信息:Robert T. Manguso等人,体内CRISPR筛选确定Ptpn2作为癌症免疫治疗靶点,自然(2017)。DOI: 10.1038 / nature23270