转向酶的“剪刀”表明阻止阿尔茨海默病的潜力
根据英国哥伦比亚大学的新研究,旧房地产谚语可能还适用于阿尔茨海默病的生物化学成因。
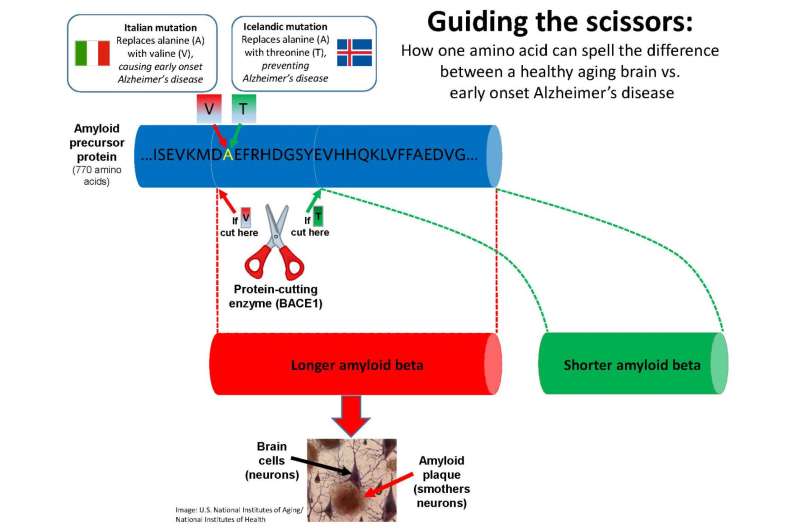
科学家们先前已经确定了一些关键步骤蛋白质被称为淀粉样蛋白β,其在具有阿尔茨海默氏病的人们的大脑中积聚在团块或“斑块”中。那些发现激发了扰乱蛋白蛋黄酱的生化雕刻的努力前体蛋白质进入最终有毒的形状。
正在测试的最新药物尝试沉默一种称为Bace1的酶,其切割前体蛋白。但Bace1还有其他有益的功能,因此完全停止它可以带来不必要的副作用 - 包括扰乱髓鞘的生产,脑细胞的保护性绝缘。
精神病学教授和阿尔茨海默的研究员威红歌发现,改变切割的削减效果,将酶的剪刀引导到不同的点 - 可以达到相同的目标,并造成较低的抵押品损伤。
在过去十年中建立了两次发现的歌曲突变:一个在意大利人中发现,导致早期发病的阿尔茨海默病,另一个在冰岛人中发现,落下阿尔茨海默病的疾病。
宋博士在UBC的Townsend家庭实验室的团队中的突出突出了两种突变的截然相反的影响,因为它们影响了770个氨基酸的前体蛋白质链的相同点,将一只酸交换给另一个酸。
作为歌曲和他的团队博士在7月19日描述的问题上神经科学杂志,他们用携带意大利基因突变的病毒注射了一组小鼠,另一组与冰岛突变组。
他们发现,受影响前体蛋白被切割的氨基酸取代。冰岛突变导致缩短的淀粉样蛋白β形式,其不会变成“粘性”并变成斑块。意大利突变产生了更长的“贴”版本淀粉样蛋白β,最终成为神经元 - 窒息的斑块。
实际上,这些效果是一个学位问题:每个突变导致更多的削减地点或者更多地切入另一个位置。但在阿尔茨海默氏症的逐渐退化疾病,这可能是足够的 - 减少冒犯毒素的水平可以在认知下降之前翻译成多年的生活。
“如果我们可以调整Bace1削减的位置前兆蛋白质,我们将有一个非常精确的方式来减慢大脑中斑块的积聚,而不会影响其他过程,“阿尔茨海默氏病和杰克布朗和家庭教授加拿大研究椅子宋博士说。”这提供了我们寻找药物的新目标 - 而不是大锤,它更像是一个手术刀。“









用户评论